COMPORTAMIENTO DEL VAPOR (PARTE I).


Buenas tardes comunidad, un saludo y un abrazo fraterno. Disculpen mi ausencia prolongada en este medio, lamentablemente tuve que atender otros proyectos de urgencia, pero ya estoy de vuelta para proseguir con este proyecto. Para nuestros nuevos lectores es importante que visiten los post anteriores, los cuales están descritos en la siguiente tabla. Esto les permitirá comprender de forma secuencial los conocimientos impartidos:

En esta oportunidad vamos a conversar sobre el comportamiento de los vapores en materia de refrigeración. En un primer plano es importante definir el concepto de Temperatura de saturación.
Temperatura de saturación: es la temperatura mediante la cual se suscita el cambio de fase de una sustancia de liquido a vapor (vaporización), o a la inversa (condensación). Cuando sucede este fenómeno, esta es la temperatura máxima que puede tener un líquido a una presión especifíca, y tambien es la temperatura mínima que puede tener un vapor a esa presión. Tambien es de importancia recordar que cuando acontece el cambio de fase, esta temperatura permanece constante. En este sentido cuando se adiciona energía al fluido este se vaporizará, y si extraemos energía, el vapor de fluido tenderá a condensarse.
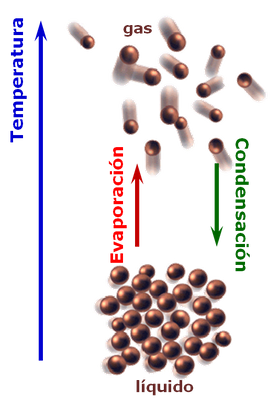
Seguidamente cuando la totalidad del líquido es vaporizado , si continuamos adicionando energía esto generará un incremento en su temperatura, el cual sera denominado temperatura del vapor sobre-calentado. De igual forma cuando condensamos la totalidad de un vapor de sustancia, si continuamos extrayendo energía, el liquido disminuira su temperatura, la cual sera denominada temperatura del líquido subenfriado
Efecto de la presión sobre la temperatura de saturación
En general el comportamiento de la temperatura de saturación con respecto a la presión es el siguiente:
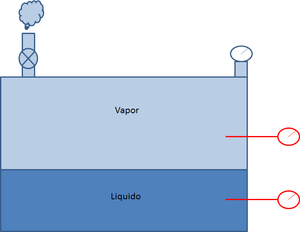
¿Ahora nos preguntamos porque sucede esto?. Consideremos que poseemos un recipiente como el que se muestra en la siguiente figura. Este en su parte superior izquierda posee una válvula, y en su parte superior derecha posee un manómetro para medir la presión del recinto. Adicionalmente en su parte izquierda instalamos dos termometros.
Inicialmente la temperatura del recipiente esta en 95°C (203°F). Si le adicionamos energía, la temperatura aumentará hasta llegar a 100 °C (212°F). Posteriormente si continuamos ese proceso, parte del líquido comenzará a vaporizarse, el espacio superior comenzará a llenarse con muchísimas moléculas de vapor , moviendose a elevadas velocidades. Si la abertura de la válvula es lo sufientemente grande, el vapor abandonará el recipiente en la misma proporción en que se vaporiza el líquido, por lo tanto permanecerá constante el número de moléculas de vapor contenidas. Esto ocasiona que su densidad y presión se mantengan, y debido a que el recipente esta abierto a la atmosfera las condiciones de cada una de sus variables de medición son las siguientes: Temperatura: 100°C, Presión: 14,7 psi abs
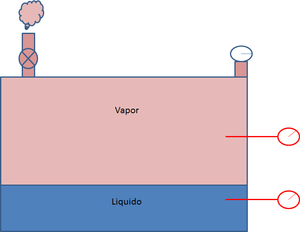
Como segundo ejercicio, cerramos parcialmente la válvula. Al realizar esto, se crea una inestabilidad en el sistema, motivado a que la cantidad de vapor que desaloja el recipiente no es la misma que en la que se vaporiza el líquido. En consecuencia se acumulan mayor cantidad de moléculas en su parte superior, lo que generá que aumente su densidad, presión y temperatura de saturación. De forma explicativa las nuevas condiciones del recipiente son: 109°C y 20 psi abs
Para finalizar este ejecicio, ahora procedemos abrir parcialmente la válvula hasta su posición inicial. Lo primero que se evidencia es que aumenta el escape del vapor en el recinto con respecto a su vaporización. En consecuencia ahora existen menos moléculas de vapor en el recipiente,por lo tanto su densidad, presión y temperatura disminuyen. En este punto sucede un fenómeno muy particular, ¿como logramos disminuir su temperatura de 109°C a 100 °C?. Bueno, esto sucede debido a que para equilibrar la proporción de líquido que debe vaporizarse, se genera una parte de vapor a expensas del consumo de la energía interna del fluido, con lo cual al ceder este energía , disminuye su temperatura.

REFERENCIAS BIBLIOGRÁFICAS
• Dossat, R. J. (1998). Principles of refrigeration. En R. J. Dossat, Principios de refrigeración (págs. 40-41). Mexico: Compañia Editorial Continental S.A.
AGRADECIMIENTOS
•@APOYOLATINO
•https://www.tutorialesteemit.com


¡Felicitaciones!
Te participamos que puedes invertir en el PROYECTO ENTROPÍA mediante tu delegación de Steem Power y así comenzar a recibir ganancias de forma semanal transferidas automáticamente a tu monedero todos los lunes. Entra aquí para más información sobre cómo invertir en ENTROPÍA.
Apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
Puedes consultar el reporte diario de curación visitando @entropia.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Congratulations @millergil21! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
Click here to view your Board of Honor
If you no longer want to receive notifications, reply to this comment with the word
STOPDo not miss the last post from @steemitboard: