COMPORTAMIENTO DEL VAPOR (PARTE II).


Buenas tardes comunidad, un saludo y un abrazo fraterno. Para nuestros nuevos lectores es importante que visiten los post anteriores, los cuales están descritos en la siguiente tabla. Su lectura les permitirá comprender de forma secuencial los conocimientos impartidos en cada uno de los artículos.

¡Comencemos! En esta oportunidad, vamos a iniciar describiendo un proceso súper interesante, mediante el cual también puede condensarse un vapor. Como se mencionó en el último post, básicamente existen dos procesos mediante el cual un gas o vapor se condensa, el primero es el que ya describimos que acontece cuando extraemos calor del vapor, y el segundo sucede por el incremento de la presión del vapor.
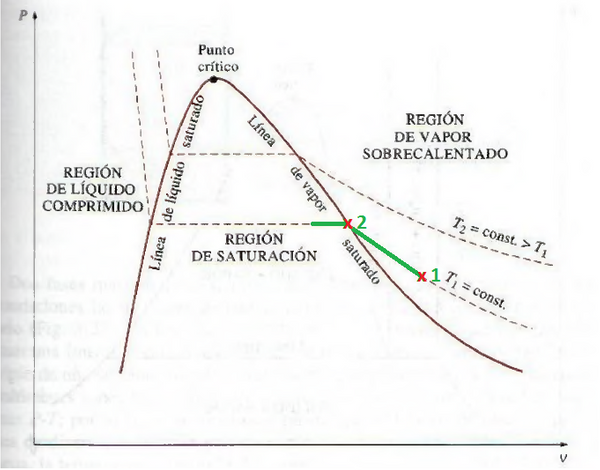
Haciendo énfasis en el segundo, para describir de forma sencilla este proceso, en la siguiente imagen se puede visualizar el diagrama de Presión vs Volumen específico de una sustancia. Si poseemos vapor sobrecalentado en las condiciones del punto 1, y lo comprimimos a temperatura constante, su volumen disminuirá, y su densidad aumentará, debido a que sus moléculas son obligadas a confinarse en un espacio mucho menor. Si continuamos el proceso de compresión, en el punto 2 la temperatura del vapor se iguala a la temperatura de saturación correspondiente a esa presión, por lo cual si continuamos comprimiendo se empezará a producir su condensación continua de vapor a fase líquida.
Otro concepto de gran importancia es la Temperatura crítica, la cual está definida como la temperatura limite mediante la cual un gas no puede llegar a condensarse aumentando su presión. Es decir, es la temperatura más alta en que una sustancia puede estar en fase liquida. Ejemplo de este concepto lo podemos ver en el Hidrogeno Líquido:
Su Temperatura crítica es de: -239.9 grados centígrados. Esto quiere decir que para lograr obtenerlo tenemos que lograr disminuir su temperatura hasta niveles inferiores de su temperatura crítica. Esto supone un gran reto de refrigeración, sin embargo ha sido resuelto, debido a que esta sustancia ha sido usada comúnmente como combustible líquido en la propulsión de cohetes.
De igual forma la Presión critica esta definida como la presión más baja en que una sustancia puede existir en estado liquido a su temperatura crítica, y estos dos valores definen el punto crítico de una sustancia.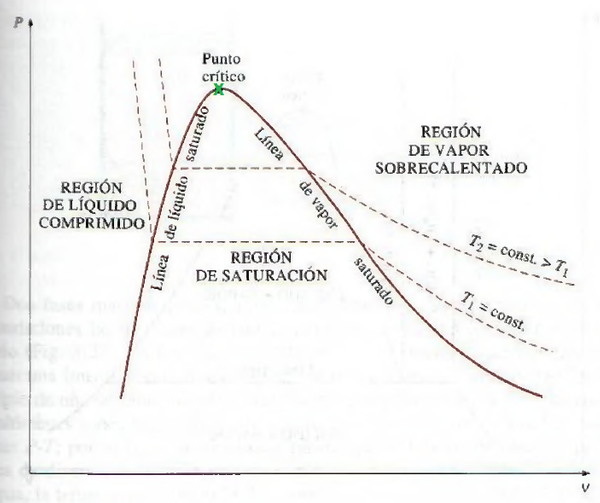

REFERENCIAS BIBLIOGRÁFICAS
• Dossat, R. J. (1998). Principles of refrigeration. En R. J. Dossat, Principios de refrigeración (págs. 40-41). Mexico: Compañia Editorial Continental S.A.
• Yunus A Cengel, Michael A Boles (2006). Thermodynamics. En “Termodinámica” , sexta edición ( pág 121). Compañia Editorial McGraw-Hill.
AGRADECIMIENTOS
•@APOYOLATINO
•https://www.tutorialesteemit.com

Interesantes y útiles temas. Felicitaciones. aliriera
Gracias hermano, saludos ...
Excelente post