Método de Job. Patrón de absorción para una solución de Etilendiamina y níquel (II)

Introducción
Una vez que se tiene el conjunto de soluciones con diferentes proporciones de metal y ligando, se mide una propiedad física que depende de la concentración de [ABn]. La diferencia entre los valores de la propiedad calculada menos los valores sin reacción son graficados en función de la composición de la mezcla.
La absorción de luz monocromática es una propiedad adecuada para este método porque los iones complejos, usualmente, presentan una coloración distinta a la de sus componentes iniciales; es decir que absorben a longitudes de onda distintas. También porque la absorción es proporcional a la concentración de las especies, condición necesaria [2].
Para la formación de complejos de níquel con etilendiamina, el método de Jobs ha logrado exitosamente determinar la proporción de ligando y metal de los complejo en solución, para las distintas especies formadas. La determinación de la estequiometría de los distintos iones complejos se logró gracias a la escogencia de longitudes de ondas características para cada ión ya que presentan absorciones distintas [2].
Fuente
[Ni(H2O)6] --->[Ni(H2O)4(en)] ---> [Ni(H2O)2(en)2] ---> [Ni(en)3]
Resultados
Las soluciones con diferentes relaciones molares entre la etilendiamina y el níquel presentaban coloraciones diferentes, yendo desde el verde en la solución sin etilendiamina hasta el morado en la solución que tenía un exceso de este, pasando por el azul profundo en soluciones intermedias. A todas las muestras se les realizó un espectro UV-Visible analizando la absorbancia a 5 longitudes de onda entre 530nm y 640nm. De esta manera se procedió a graficar la absorbancia de las soluciones a diferentes longitudes de onda con respecto a la relación molar de la etilendiamina en contra del niquel, esta fue calculada al dividir la concentración de los reactivos. (Figura 1)
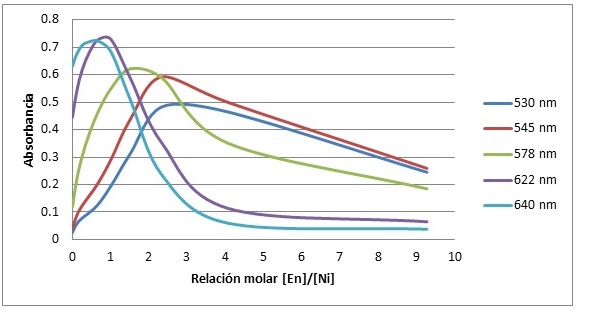
Figura N°1. Relación de la absorbancia con respecto a la relación molar de la etilendiamina en níquel para 5 longitudes de onda diferentes.
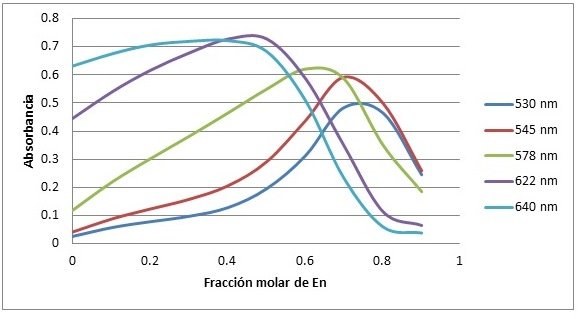
Figura N°2. Relación de la absorbancia y la fracción molar de etilendiamina en solución de níquel para 5 longitudes de onda diferentes.
| Longitud de onda (nm) | Relación molar con absorbancia mayor del método 1 | Relación molar calculada de la fracción molar del método 2 |
|---|---|---|
| 530 | 3.18 | 3.17 |
| 545 | 2.99 | 2.88 |
| 578 | 1.71 | 1.51 |
| 622 | 0.82 | 0.653 |
| 640 | 0.52 | 0.515 |
Discusión
Transiciones electrónicas
Los complejos formados, al estar expuestos a un ambiente químico diferente dependiendo de los equivalentes de etilendiamina por cada centro metálico de níquel[4], absorben en diferentes longitudes de onda ya que la excitación de un electrón al absorber el fotón correspondiente atiende a una energía de estabilización diferente. Para el níquel (II) el cual es un d8 se tienen que considerar tres transiciones electrónicas 3A2g ---> 3T2g , 3A2g ---> 3T1g (F), y 3A2g ---> 3T1g(P)[5], las cuales harán que hayan 3 bandas de absorción en el espectro, y estas variarán dependiendo del ambiente químico al que esté sometido el complejo.
Precisamente por ello se puede observar un cambio en la longitud de onda absorbida y en el color de las soluciones. Las longitudes de onda esperadas para los compuestos [Ni(H2O)6], [Ni(En)(H2O)4], [Ni(En)2(H2O)2] y [Ni(En)3] [6]en diferentes relaciones molares de etilendiamina y níquel según la literatura se encuentran en la tabla N°2.
Teoría de campo cristalino
| Relación molar de En con respecto al níquel | EECC (Ev) | Error en la medida (Ev) |
|---|---|---|
| 0 | 1.1286 | 0.0008 |
| 0.43 | 1.2244 | 0.0010 |
| 0.67 | 1.2733 | 0.0012 |
| 1 | 1.2879 | 0.0014 |
| 1.5 | 1.3096 | 0.0014 |
| 2.3 | 1.3553 | 0.0012 |
| 4 | 1.4044 | 0.0008 |
| 9 | 1.4076 | 0.0005 |
Fuerza del enlace metal ligando
Mientras menor sea la transición energética, mayor será la energía de esta, y al relacionarlo con una excitación electrónica, considerando la EECC, se puede saber que el enlace etilendiamina níquel es más fuerte que el formado con el agua[4]. Esta consideración entraría en concordancia con la disminución de la longitud de enlace entre el ligando y el centro metálico[6], indicando de igual manera el carácter covalente del enlace aumenta mientras mayor sea la concentración de etilendiamina en la solución.
Esto podría explicarse si se considera la formación de un quelato entre la etilendiamina que es un ligando bidentado y el níquel, considerando que la formación de un metalaciclo de 5 miembros, lo cual le da una estabilidad muy grande al compuesto, favoreciendo el desplazamiento del agua como ligando y permitiendo de igual manera que la EECC aumente considerablemente. De igual forma está la serie espectroquímica, que da una guía sobre la fuerza de los ligandos, y en donde el ligando aquo es débil mientras que la etilendiamina es intermedio, explicando el cambio en la fuerza del enlace metal ligando[4].
Colores complementarios
Cabe considerar que la coloración de los compuestos en solución está directamente relacionada con la absorción a ciertas longitudes de onda en la región del visible, esto se puede corroborarse al observar la coloración de las soluciones con diferentes fracciones molares. En el caso de la solución sin etilendiamina donde solamente hay hexaaquoníquel (II), el pico de absorción se encuentra en 657nm, que se relaciona con el color rojo, su color complementario es el verde, por lo que esto explica la coloración observada en el laboratorio.
De manera similar está la solución saturada de etilendiamina que tiene una coloración morada, esto entra en concordancia con que su pico de absorción se encuentre en 541nm, longitud de onda propia del color amarillo. De igual manera se pueden relacionar todos los colores observados en la solución con el pico de absorbancia, corroborando de esta manera la teoría de los colores complementarios.
Conclusiones
Mediante las observaciones realizadas se comprobó la presencia de 3 compuestos de níquel con etilendiamina, el [Ni(En)(H2O)4], [Ni(En)2(H2O)2] y [Ni(En)3]. y se calcularon las EECC propias para las diferentes longitudes de onda a las que absorbían las soluciones con fracciones molares diferentes, confirmando la teoría de campo cristalino, la serie espectroquímica y la estabilidad que le brinda la formación de ciclos entre el ligando y el metal, al observar un aumento de la EECC al aumentar la concentración de etilendiamina con respecto a la del níquel. Esto confirma de igual forma que el enlace formado con la etilendiamina sea más fuerte que con el agua, y que por lo tanto las longitudes de onda a la que absorbe el complejo sean menores mientras mayor sea la cantidad de etilendiaminas en su esfera coordinativa. Las observaciones se complementaron de igual forma con la teoría de colores complementarios al variar, como predice esta, el color observado en solución en función de la longitud de onda que absorbe el complejo.
Referencias
[1] Job, Ann. chim., [10] 9, 113 (1928)
[2] Vosburgh, W. Cooper, G. (1941) “Complex Ions. I. The Identification of Complex Ions in Solution by Spectrophotometric Measurements” Contribution from the department of chemistry of Duke University.
[3] Hill, Z. MacCarthy, P (1986) Novel approach to job´s method. Journal of chemical education. Vol 63.
[4] Miessler, G. (2014) “Inorganic Chemistry” Ed: Pearson. Fifth edition.
[5] Ali-Mohamed (2002) Diaqua bis-ethylenediamine and tetra aquaetylenediamine nickel(II) sulfate complexes. Kluwer Academic Publishers. Vol 27.
[6] Escobal, J. Pizarro, J. Mesa, J. Arriortua, M. Rojo, T. (2000) “An ionic Nickel(II) phosphate with Ethylenediamine: (C2H10N2)Ni(H2O)62. Hydrothermal Synthesis, Crystal Structure, and Spectroscopic Properties. Journal of Solid State Chemistry. Vol 154.
Felicidades!
