Efectos fisiológicos ejercidos por reguladores de crecimiento y la calidad de luz en plántulas de caraota (Phaseolus vulgaris) y semillas de lechuga (Lactuca sativa)
La germinación de semillas sensibles a la luz viene determinada por el estado de actividad de los fitocromos. Estos son cromoproteínas que intercambian de estado activo a inactivo en función de si reciben luz del tipo rojo lejano, o viceversa si reciben luz roja. Los fitocromos actúan como los receptores de la señal lumínica y luego la transforman en una respuesta fisiológica regulando la expresión de los reguladores de crecimiento giberelinas y ácido abscísico (ABA). En este sentido, se describe el proceso de determinación del efecto de la calidad de luz y distintos reguladores de crecimiento sobre la germinación de semillas de lechuga (Lactuca sativa) y sobre la longitud del hipocotilo.
Por otra parte, también se presenta la evaluación del efecto de la cinetina (K) en el retardo de la senescencia foliar en caraotas (Phaseolus vulgaris). Para lo primero, se evaluaron distintas combinaciones de pulsos de luz del tipo rojo (R) y rojo lejano (RL), variando el orden y el tiempo del tratamiento. En cuanto a los reguladores, se usaron diferentes combinaciones y concentraciones de ácido giberélico (GA3), ácido abscísico (ABA) y cloruro de clorocolina (CCC), evaluando además el efecto del GA3 sobre la longitud del hipocotilo. Algunas de las conclusiones indican que si existe un retardo de la senescencia foliar por acción de la cinetina; la exposición a R estimula la germinación en la mayoría de los casos mientras que la RL inhibe parcialmente la germinación, entre otras.
1. INTRODUCCIÓN
Al término de la embriogénesis, el embrión dentro de la semilla entra en un estado de latencia o dormancia. La semilla latente no germina, pudiendo sobrevivir a diferentes condiciones ambientales hostiles tales como la deshidratación y altas o bajas temperaturas (Nonogaki et al., 2010). Eventualmente, las semillas germinan en ciertas condiciones, debido a que están equipadas con sensores y maquinaria sofisticada para monitorear y determinar si un ambiente en particular es ideal para la germinación y el subsiguiente crecimiento. En plantas con semillas pequeñas, como la lechuga, el tomate y el tabaco, la luz y su calidad, es un importante factor regulador de la germinación (Seo et al., 2009). En este sentido, en las plantas se conocen al menos cuatro tipos diferentes de fotorreceptores, entre los cuales los fitocromos, receptores de luz tipo rojo (R)/rojo-lejano (RL), son los más involucrados en la germinación de semillas fotoblásticas (Bae & Choi, 2008).
Los fitocromos son cromoproteínas que pueden encontrarse en dos formas interconvertibles. Una forma biológicamente inactiva que absorbe luz roja (Pr) y otra forma activa que absorbe luz en el rango del rojo lejano (Pfr) convirtiéndose en Pr (Pimentel & Contreras, 2014). Así, diferentes estudios apuntan a que una mayor cantidad de Pfr en relación con Pr en semillas fotoblásticas positivas, resulta en la germinación. Siendo este un mecanismo para determinar que la semilla lo haga en un ambiente con luz abundante y de alta calidad (Barcelo et al., 2014). Las señales de luz recibidas por los fitocromos son convertidas en mensajes internos, que terminan por regular procesos fisiológicos en las semillas. Las giberelinas (GA) y el ácido abscísico (ABA) son las señales internas (reguladores de crecimiento) que juegan un papel central en la germinación de las semillas; las GA inducen y el ABA inhibe la germinación (Seo et al, 2009).
Una vez que las semillas han germinado y la planta continua su desarrollo, algunas otras sustancias determinan cómo se da el crecimiento. Estas se denominan reguladores de crecimiento o fitohormonas, y son sustancias de naturaleza orgánica, generalmente encontradas a bajas concentraciones, que se producen en un tejido de la planta y son transportadas hacia otro, en donde provocan una respuesta fisiológica particular (Vandenberghe et al., 2014). Se sabe que al menos cinco reguladores de crecimiento intervienen dramáticamente en el desarrollo de la planta, las GA, auxinas, etileno, citoquininas, y el ABA, pudiendo tener efectos diferenciales sobre varios tejidos en una misma planta (Taiz & Zeiger, 2002).
Desde el punto de vista industrial y científico, el control del desarrollo de una planta mediante reguladores de crecimiento, puede representar mayores ganancias, optimización del tiempo, y mejores resultados (Lozano & Leaden, 2001). En este sentido, en el presente estudio de describe la determinación del efecto de los reguladores de crecimiento cinetina (K), ABA, ácido giberélico (GA3) y cloruro de clorocolina (CCC) en la germinación de semillas de lechuga (Lactuca sativa), evaluando además el efecto de la luz independientemente y en combinación con los reguladores de crecimiento. Finalmente, se presenta también la evaluación de la cinetina (K) en la senescencia foliar de plántulas de P. vulgaris.
2. MATERIALES Y MÉTODOS
2.1. Efecto de la cinetina en la senescencia de discos foliares
Se dejaron discos foliares de plántulas de P. vulgaris en oscuridad continua a temperatura ambiente durante una semana, en agua esteril, y cinetina (K) en concentraciones de 0,01; 0,1; 1; 5; 10 y 100 mg/L, más una concentración desconocida. Después de transcurrido el tiempo se determinó la concentración de clorofila, como indicador de senescencia, extrayendo el pigmento por calentamiento en etanol al 80 %, al que se le determinó luego la absorbancia a 652 nm. La clorofila total (μg/mL) se calculó como = (28,98)*(Abs a 652 nm), según Brusina (1963).
2.2. Efecto de reguladores de crecimiento y de la luz en la germinación
En todos los casos se emplearon semillas de Lactuca sativa hidratadas durante 1 h en luz verde, las cuales se sometieron a distintos tratamientos, por una duración determinada. Los resultados se expresan en función del porcentaje de germinación promedio.
2.2.1. Efecto de la luz
Las semillas se sometieron a los tratamientos mostrados en la Tabla I, y fueron luego dejadas durante 18 h en oscuridad a 28 °C.
Tabla I. Tratamiento de luz aplicado en cada caso. Rojo (R). Rojo lejano (RL).
| CONDICIÓN | TRATAMIENTO |
|---|---|
| a | Oscuridad a 28oC |
| b | Oscuridad temperatura ambiente |
| c | Luz temperatura ambiente |
| d | 5min R (660 a 770nm) |
| e | 10min R |
| f | 20min R |
| g | 5min RL (770 a 800nm) |
| h | 10min RL |
| i | 20min RL |
| j | 5min R + 5min RL |
| k | 20min R + 20min RL |
| l | 5min RL + 5min R |
| m | 20min RL + 20min R |
| n | 20min R + 20min RL + 20min R |
Las muestras se sometieron al tratamiento lumínico indicado en la Tabla II durante 20 min, y fueron dejadas en el tratamiento de reguladores de crecimiento por 18 h en oscuridad continua a 28 °C.
Tabla II. Tratamiento de luz y reguladores de crecimiento aplicado en cada caso. Ácido giberélico (GA3), ácido abscísico (ABA), cloruro de clorocolina (CCC), rojo (R), oscuridad (Osc).
| CONDICIÓN | SOLUCIÓN (M) | TRATAMIENTO |
|---|---|---|
| a | Agua destilada | Osc |
| b | GA3 1x10-4 - Osc | Osc |
| c | ABA 1x10-4 | Osc |
| d | CCC 1x10-4 | Osc |
| e | Agua destilada | R |
| f | GA3 1x10-4 | R |
| g | ABA 1x10-4 | R |
| h | CCC 1x10-4 | R |
| i | GA3 1x10-4 y CCC 1x10-4 | Osc |
| j | GA3 1x10-4 y ABA 1x10-4 | Osc |
| k | GA3 1x10-4 y ABA 1x10-6 | Osc |
| l | GA3 1x10-4 y CCC 1x10-4 | R (660 a 770nm) |
| m | GA3 1x10-4 y ABA 1x10-4 | R |
| n | GA3 1x10-4 y ABA 1x10-6 | R |
2.2.3. Efecto de la cinetina en conjunto con luz
Se dejaron las semillas en imbibición en cinetina 2 mg/L, luego de lo cual fueron tratadas con (a) Oscuridad continua a 28 °C, (b) luz continua a temperatura ambiente, (c) 20 min R, (d) 20 min RL, (e) 20 min R + 20 min RL, (f) 20 min RL + 20 min R y (g) 20 min R + 20 min RL + 20 min R. Todas fueron dejadas 20 h en oscuridad continua a 28 °C.
2.3. Efecto del ácido giberélico en el crecimiento de hipocotilos
Se emplearon semillas germinadas de Lactuca sativa con una longitud de radícula de 4 mm. En función del crecimiento del hipocotilo luego de los seis días de tratamiento, se evaluaron concentraciones de 0; 0,5; 1; 3; 5; 10 y 20 mg/L de ácido giberélico.
3. RESULTADOS Y DISCUSIÓN
3.1. Efecto de la cinetina en la senescencia foliar
El máximo de clorofila se observó en 0,01 mg/L con un valor cercano a 8 μg/mL, luego de dicho máximo los valores descendieron hasta un mínimo de menos de 6 μg/mL en 5 mg/L de cinetina, para posteriormente mantenerse contante en 7 μg/mL en concentraciones de cinetina mayores a 5 mg/L (Fig. 1).
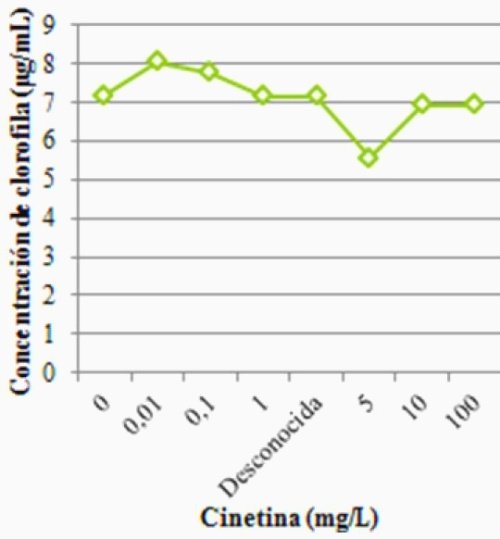
Figura 1. Concentración de clorofila en función de la concentración de cinetina en discos foliares de P. vulgaris, como indicador de senescencia.
Durante la senescencia foliar hay pérdida de clorofila y por tanto de actividad fotosintética. Esto ocurre ya que se reduce la cantidad de proteínas, ARN y el tejido sufre estrés oxidativo, por la producción de especies reactivas de oxígeno que dañan a la célula y contribuyen a la muerte del órgano (Prochazkova et al., 2001). Las citocininas, permiten el desarrollo de cloroplastos (con formación de granas) en oscuridad, reemplazando parcialmente la demanda de luz. Una mayor permanencia de clorofilas activas implica para la hoja y la planta la conservación de la síntesis de proteínas y consiguiente transcripción de varios genes. La presencia de citocininas provoca un efecto “sumidero” en el transporte de varias “materias primas” (por ejemplo aminoácidos) hacia los tejidos donde se encuentra la hormona y donde estos recursos serán usados para la síntesis de nuevas proteínas, por tanto retardando la senescencia foliar (Jordán & Casaretto, 2006).
La cinetina se caracteriza entre otros varios efectos, por la capacidad de retardar la senescencia foliar debido además, a la fosforilación de ciertos dominios, que resultan en la atenuación del proceso de senescencia (Kim et al., 2006). Así, se esperaba observar que a medida que la concentración de cinetina aumentara, la concentración de clorofila fuese también mayor, pues se sabe que en hojas senescentes la clorofila tiende a perderse (Azcón-Bieto & Talón, 2008). En este sentido, el leve aumento observado en bajas concentraciones de cinetina se explica precisamente, por el hecho de que al retardar la senescencia, hay una mayor concentración de clorofila contenida en las hojas. Por su parte, la disminución progresiva observada luego del máximo de clorofila, pudo deberse a que a concentraciones elevadas de citoquininas, al igual que la mayoría de los reguladores de crecimiento (por lo general por encima del 10% o del 1x10-4 M), esta pasa a ejercer un efecto citotóxico (Takei et al., 2001). Si bien la mayoría de las concentraciones evaluadas no superaban los rangos tóxicos, se debe tomar en cuenta que no se trataba de un órgano completo, sino de un disco foliar, el cual pudo ser susceptible a las altas concentraciones y por tanto morir en vez de retardar la senescencia. La muestra desconocida parece haber correspondido con 1 mg/L de cinetina, pues coincidió con el valor de clorofila encontrado en dicha concentración.
3.2. Efecto de la luz en la germinación
Los porcentajes de germinación más altos se observaron en los tratamientos de 5 min de R, 10 min RL, 5 min R + 5 min RL y 5 min RL + 5 min R, siendo estos por encima del 80 % (Fig. 2). Por su parte, los porcentajes más bajos de germinación se encontraron en las muestras de 20 min R + 20 min RL y de 20 min RL + 20 min R, siendo estos por debajo del 60 %. Todos los demás tratamientos presentaron porcentajes de germinación muy similares entre sí, en el rango entre los 80 y los 60 %. Algunas medidas, como las de 20 min R, 10 min R, 20 min R + 20 min RL y 20 min RL + 20 min R, presentaron desviaciones estándar altas.
Las semillas de lechuga son del tipo fotoblásticas positivas, cuya germinación es por consiguiente estimulada por la incidencia de luz, en este caso roja (Contreras, 2009). Esto es así, debido a la presencia de una familia de cromoproteínas denominada fitocromo, que se convierten a forma activa (Pfr) en luz roja, y a forma inactiva (Pr) en luz del tipo rojo lejano. Una vez activo, el fitocromo se transporta hasta el núcleo en el que inicia varias vías de señalización tales que disparan la producción de giberelinas y reprimen la producción de ácido abscísico (Sawada et al., 2008). Así, la germinación se
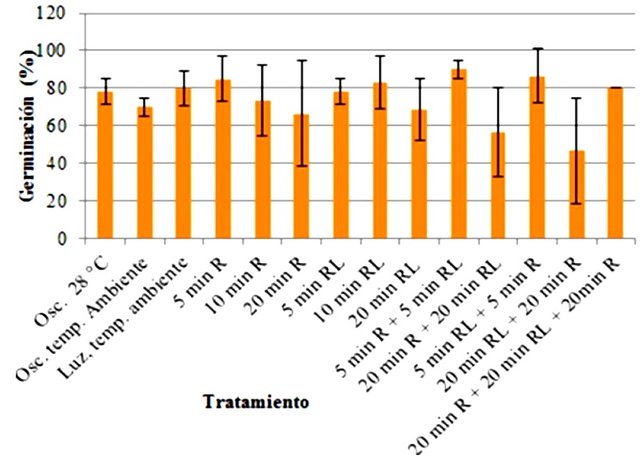
Figura 2. Porcentajes de germinación de semillas de Lactuca sativa en función del tratamiento con luz del tipo rojo (R) y rojo lejano (RL) en órdenes y tiempos diferentes.
determina en función de la proporción Pfr/Pr, de manera que si esta es mayor que 1, la semilla germina, y si es menor que 1, la semilla permanece en latencia (Toyomasu, 1998). En cuanto al orden de exposición, el tratamiento final de luz es el que suele prevalecer dependiendo del tiempo de exposición, que determina la relación Pfr/Pr (Lee et al., 2011).
En función de lo antes expuesto, se esperaba que en los experimentos en los que el R fuese el último tratamiento, hubiese mayor porcentaje de germinación. Sin embargo, en casos como los de 20 min R + 20 min RL, 10 min RL y 5 min R + 5 min RL se observaron altos porcentajes. En el primer caso, esto se puede explicar ya que si bien los tiempos de exposición fueron iguales, quizás había mucha forma activa del fitocromo, y por tanto muchas semillas lograron germinar. Esto pudo verse también influenciado por errores durante la irradiación o imbibición de las semillas. Adicionalmente, al realizar el tratamiento inverso (20 min RL + 20 min R), se observó un comportamiento similar, en cuanto a que a pesar de que el último pulso fue de rojo y fue de la misma duración que el inicial, este no fue suficiente para revertir la relación Pfr/Pr y por tanto se observaron bajos porcentajes de germinación. Un razonamiento similar pudiese ser empleado en el resto de los casos, sin embargo, es más factible pensar que hubo errores durante la aplicación de los tratamientos, con base en las altas desviaciones estándar observadas.
En todo caso, se recomienda la realización de más réplicas en condiciones más controladas. Finalmente, se observó mayor germinación a temperatura ambiente, probablemente debido a que siempre hubo luz, en relación con las semillas a temperatura ambiente y en oscuridad y a 28 °C y en oscuridad, a pesar de que la temperatura óptima de germinación de semillas de lechuga se aproxima a los 28 °C (Schwember & Bradford, 2010).
3.3. Efecto de los reguladores de crecimiento en conjunto con luz en la germinación
El tratamiento con GA3-CCC-Osc presentó el mayor porcentaje de germinación, por encima del 70 %, seguido del tratamiento de GA3-Osc cerca del 70 %. En los tratamientos con agua-R y ABA-R no se observó germinación, y similarmente en los tratamientos con ABA-Ocs y GA3-ABA-R se observó poca germinación (Fig. 3). En los tratamientos con GA3-ABA 1x10-6 M-Osc y GA3-ABA 1x10-6 M-R el porcentaje de germinación se encontró entre el 50 y 60 %.
El ácido giberélico y el ácido abscísico son reguladores de crecimiento relacionados directamente con la germinación de las semillas en lechuga, pues se asocian estrechamente con las vías de señalización acopladas a la acción del fitocromo. La primera induce la germinación mediante la expresión de amilasa, para utilizar las reservas energéticas y la segunda la inhibe (Vandenberghe et al., 2014).
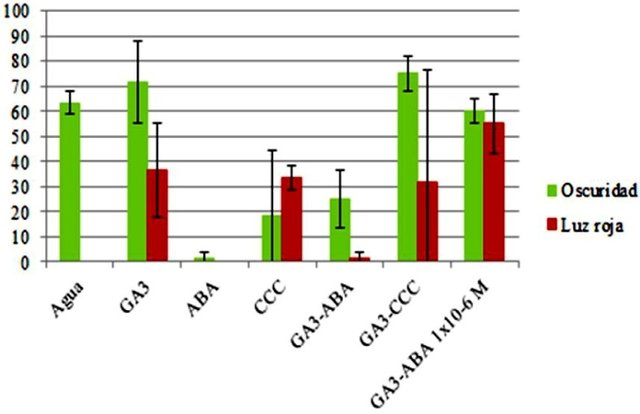
Figura 3. Porcentaje de germinación de semillas de Lactuca sativa en función del tratamiento con reguladores de crecimiento y luz. Ácido giberélico (GA3), ácido abscísico (ABA), cloruro de clorocolina (CCC).
Por su parte, el cloruro de clorocolina, impide la elongación de las células e imposibilita temporalmente la biosíntesis de las giberelinas naturales con lo que se produce la detención de la elongación celular de los órganos vegetativos (De Liñán, 2015). Particularmente, en presencia de giberelinas se espera que las semillas de lechuga presenten porcentajes cercanos al 70 % de germinación (Kahn & Goss, 1970), siempre que no se vean afectadas por ningún otro regulador de crecimiento.
En el tratamiento con agua, se esperaba que las semillas sometidas a luz roja presentaran el más alto porcentaje de germinación, sin embargo ninguna de ellas germinó, quizás producto de algún error durante la experimentación. Tentativamente, se podría pensar que las semillas no estaban bien hidratadas y fueron poco susceptibles al tratamiento. En cuanto al GA3, nuevamente se esperaba que en luz roja, el porcentaje de germinación fuese más alto respecto del porcentaje en oscuridad, pues en esta última hay menos fitocromo activo y por tanto menos concentración endógena de GA3. En el caso de los inhibidores ABA y CCC se esperaba de igual forma que el mayor porcentaje de germinación fuese en la condición sometida a luz, y de nuevo no fue así en ambos casos. Finalmente, con la presencia de ABA y CCC en conjunto con GA3 a las mismas concentraciones y de ABA en menor concentración que GA3 también se esperaba un mayor porcentaje de germinación en las plantas con luz, y no fue así.
El hecho de que los resultados en su mayoría fuesen inesperados y con una misma tendencia (los sometidos a luz presentaban menos germinación), invita a pensar en que algo en el tratamiento con luz puedo dañar o afectar (1) las semillas (su maquinaria enzimática) o (2) los reguladores de crecimiento en solución. Siendo la primera explicación la más factible ya que se sabe que a temperaturas por encima de los 33-35 °C en el periodo de hidratación y posterior a esta generan inhibición de la germinación producto del daño en los fitocromos (Scheibe & Lang, 1969). Dichas condiciones pudieron haberse dado producto del calor emanado por las lámparas durante el tratamiento de 20 min en rojo, generando así una baja germinación de las semillas. Esto último gana validez, al notar que no hubo germinación alguna en el control (agua destilada + luz roja).
3.4. Efecto de la cinetina en conjunto con luz en la germinación
Los mayores porcentajes de germinación se observaron en oscuridad a 28 °C, a temperatura ambiente y después del tratamiento con 20 min de RL. Por el contrario, los porcentajes más bajos se obtuvieron después del tratamiento de 20 min R + 20 min RL + 20 min R y con 20 min R (Fig. 4).
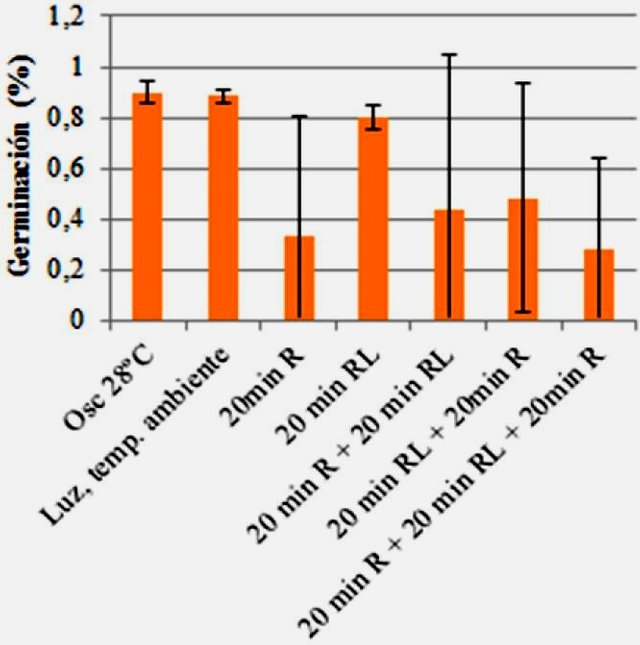
Figura 4. Porcentaje de germinación de semillas de Lactuca sativa en función de distintos tratamientos lumínicos después de hidratar en cinetina. Luz roja (R), luz roja lejana (RL), oscuridad (Osc).
La cinetina, es un regulador de crecimiento que promueve la división y diferenciación celular, y además promueve la división de las células de la radícula de los embriones en las semillas, incentivando así la germinación de estas (Barcelo et al., 2014), y por tanto aumentando el porcentaje de germinación. Esto ha sido registrado en distintas ocasiones para las semillas de lechuga, las cuales alcanzan porcentajes de germinación mayores cuando son embebidas en cinetina en relación con las embebidas en agua (Miller, 1957; Leff, 1964). En oscuridad y temperatura ambiente, los porcentajes fueron casi iguales, debido al efecto de la cinetina, pues a pesar de no haber mucha forma activa del fitocromo en la primera, hubo un alto porcentaje de germinación. En cuanto a los tratamientos con R y RL, de nuevo se observa la tendencia antes mencionada y tentativamente explicada en cuanto a la disminución de la germinación en los tratamientos con R, solo que esta vez respecto de los tratamientos con RL. Esto da señal de que la posible inactivación por calor del fitocromo está relacionada a la lámpara empleada para los tratamientos con R y no a los tratamientos con RL. En todo caso, se recomienda realizar más muestras, para disminuir las grandes desviaciones estándar observadas, alejar la lámpara de las muestras, y adicionar controles sin cinetina.
3.5 Efecto del ácido giberélico en el crecimiento de hipocotilos
A medida que la concentración de ácido giberélico fue aumentando hasta 5 mg/mL también lo hizo así la longitud del hipocotilo. Luego de esto, esta empezó a descender (es decir, no aumento, en realidad) con algunas fluctuaciones hasta alcanzar un valor mínimo de 3 cm (Fig. 5). En todos los puntos, la desviación estándar observada fue grande, por lo que las fluctuaciones pueden explicarse en función de las variaciones entre las muestras, quizás producto de errores en las mediciones.
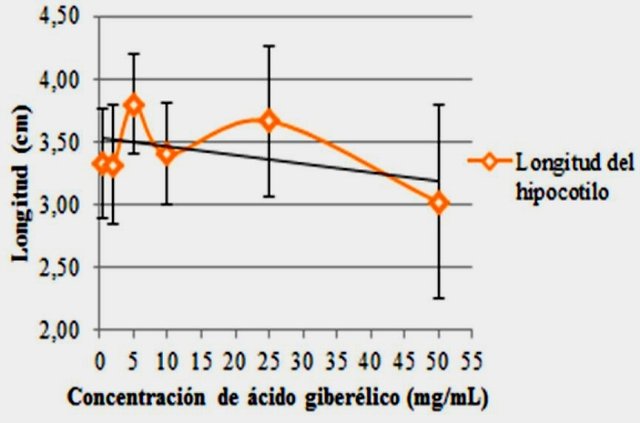
Figura 5. Longitud del hipocotilo de Lactuca sativa en función de la concentración de ácido giberélico.
En todo caso el GA3, es conocido por ser regulador en el desarrollo de la planta y crecimiento del tallo, la concentración de ácido giberélico bioactivo se encuentra en el rango de 10-11 y 10-9 g/g de peso fresco, dependiendo del tejido (Barceló et al., 2014). El aumento en la longitud del hipocotilo observado al inicio se debe a que además de poseer giberelinas de carácter endógeno, se le agregan las exógenas, causando la producción de α-amilasas y otras enzimas hidrolíticas que permiten degradar gran cantidad de compuestos orgánicos, liberando energía extra para el alargamiento del hipocotilo (Jordán & Casaretto, 2006).
En este sentido, el posterior descenso en la longitud del hipocotilo puede deberse a que los reguladores mejoran su efecto cuando son aplicados a bajas concentraciones (Bolivar, 2002), y además es posible que las dosis altas de GA hayan actuado en forma negativa, ejerciendo un efecto más bien tóxico (Rojas & Ramírez, 1993).
4. CONCLUSIONES
• La cinetina retardó la senescencia en discos foliares de P. vulgaris al estar en concentraciones de 0,01 y 0,1 mg/L.
• La exposición a la luz roja estimula la germinación en la mayoría de los casos, mientras que la exposición a la luz del tipo rojo lejano inhibe parcialmente la germinación.
• Las semillas expuestas a luz a temperatura ambiente, presentan mayores porcentajes de germinación en relación con las semillas a 28 °C y en oscuridad.
• El ácido abscísico inhibió por completo la germinación de semillas, tanto en oscuridad como luego del tratamiento con luz roja.
• El cloruro de clorocolina presenta una inhibición más leve en relación con el ácido abscísico.
• El ácido abscísico presenta mayor inhibición sobre la germinación en presencia de ácido giberélico en relación con el cloruro de clorocolina.
• La cinetina aumentó el porcentaje de germinación en semillas en oscuridad y en luz ambiental.
• Concentraciones de ácido giberélico igual o menores a 5 mg/L incentivaron el aumento en longitud del hipocotilo, mientras que concentraciones superiores más bien limitaron su elongación.
5. REFERENCIAS BIBLIOGRÁFICAS
• Azcón-Bieto, J. & M. Talón. (2008). Fundamentos de fisiología vegetal. McGraw Hill Interamericana. Madrid, España. 651 pp.
• Bae. G. & G. Choi. (2008). Decoding of light signals by plant phytochromes and their interacting proteins. Annu Rev Plant Biol. 59: 281-311.
• Barceló, J., G. Nicolás, B. Sabater & R. Sánchez. (2014). Fisiología Vegetal. Ediciones Pirámide. Madrid, España. 566 pp.
• Bólivar, E. (2002). Efecto del ácido giberélico y del contenido de humedad sobre la germinación de la semilla de jaca (Artocarpus heterophyllus Lam.). Trabajo de grado, Escuela de Ingeniería. Escuela Agrícola Panamericana. El Zamorano, Honduras. 27 pp.
• Contreras, S. (2009). Red to Far-red Ratio During Seed Development Affects Lettuce Seed Germinability and Longevity. Hort Science. 44(1): 130-134.
• De Liñán, C. (2015). Vademecum de productos fitosanitarios y nutricionales. Ediciones Agrotécnicas. Madrid, España. 250 pp.
• Jordán, M. & J. Casaretto. (2006). Hormonas y Reguladores del Crecimiento: Auxinas, Giberelinas y Citocininas. Universidad de la Serena. La Serena, Chile. 16 pp.
• Kahn, A. & J. Goss. (1970). Effect of Gibberellin on Germination of Lettuce Seed. Science. 125: 645-646.
• Kim, J., H. Ryu, S. Hong, H. Woo, P. Lim, I. Lee, J. Sheen, H. Nam & I. Hwang. (2006). Cytokinin-mediated control of leaf longevity by AHK3 through phosphorylation of ARR2 in Arabidopsis. Proc Natl Acad Sci. 103: 814-819.
• Lee, A., D. Urbina1y, M. Pinto. (2011). Fotorreceptores y Respuestas de Plantas a Señales Lumínicas. Ediciones Universidad de La Serena, La Serena, Chile. 10 pp.
• Leff, J. (1964). Interaction between Kinetin and Light on Germination of Grand Rapids Lettuce Seeds. Plant Physiol. 39(3): 299-303.
• Lozano, C. & M Leaden. (2001). Efectos de reguladores de crecimiento sobre el rendimiento y altura en dos cultivares de trigo. V Congreso Nacional de Trigo. Facultad de Ciencias Agrarias. Provincia de Cordoba, Argentina. 4 pp.
• Miller, C. (1957). The relationship of the kinetin and red-light promotions of lettuce seed germination. Plant Physiol. 33(2): 115-117.
• Nonogaki, H., G. Baseel & J. Bewley. (2010). Germination, still a mystery. Plant science. 179: 574-581.
• Pimentel, I. & S. Contreras. (2014). Red and Far-red Light Treatments to Modify Thermoinhibition, Photoblasticity, and Longevity in Lettuce Seeds. Hort Technology. 24(4): 463-470.
• Prochazkova, D., R. Sairam, G. Srivastava & D. Singh. (2001). Oxidative stress and antioxidant activity as the basis of senescence in maize leaves. Plant Science. 161: 765-771.
• Roja, M. & H Ramírez. (1993). Control Hormonal del Desarrollo de las Plantas. Editorial Limusa. Distrito Federal, México. 236 pp.
• Sawada, Y., T. Katsumata, J. Kitamura, H. Kawaide, M. Nakajima, T. Asami, K. Nakaminami, T. Kurahashi, W. Mitsuhashi, Y. Inoue & T. Toyomasu. (2008). Germination of photoblastic lettuce seeds is regulated via the control of endogenous physiologically active gibberellin content, rather than of gibberellin responsiveness. Journal of Experimental Botany. 59(12): 3383-3393.
• Schiebe, J. & A. Lang. (1969). Lettuce seed germination: effects of high temperature and repeated far-red treatment in relation to phytochrome. Phorochem Photobiol. 9: 143-150.
• Schwember, A. & K. Bradford. (2010). A genetic locus and gene expression patterns associated with the priming effect on lettuce seed germination at elevated temperatures. Plant Mol Biol. 73: 105-118.
• Seo, M., E. Nambara, G. Choi & S. Yamaguchi. (2009). Interaction of light and hormone signals in germinating seeds. Plant Mol Biol. 69: 463-472.
• Taiz, L. & E. Zeiger. (2002). Plant physiology. Sinauer Associates, Inc. Sunderland, Estados Unidos de América. 623 pp.
• Takei, K., H. Sakakibara, M. Taniguchi & M. Sugiyama. (2001). Nitrogen-dependent accumulation of cytokinins in root and the translocation to leaf: implication of cytokinin species that induces gene expression of maize response regulator. Plant Cell Physiol. 42: 85-93.
• Toyomasu, T., H. Kawaide, W. Mitsuhashi, Y. Inoue & Y. Kamiya.(1998). Phytochrome Regulates Gibberellin Biosynthesis during Germination of Photoblastic Lettuce Seeds. Plant Physiol. 118: 1517-1523.
• Vandenbergue, L., C. Rodrigues, J. de Olivera & C. Soccol. (2014). Chapter 8: Plant Growth Hormones and Other Phytochemicals. Springer Science. Paraná, Brazil. 82 pp.
¡Felicidades, #proconocimiento te valoró!
Has sido reconocido(a) por tu buen post por el Comité de Arbitraje y Valoración del Proyecto Conocimiento @proconocimiento.
Apoyamos y valoramos tu esfuerzo...
Proyecto Conocimiento es parte de la comunidad @provenezuela.
Hi @khrisaeroth!
Your post was upvoted by utopian.io in cooperation with steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV