Ácido sulfúrico. Parte II: reacciones
Saludos estimados amigos de steemit y apreciada comunidad de @stem-espanol.
Como les comenté en mi anterior post, uno de los ácidos de mayor uso en los laboratorios de química es el ácido sulfúrico, es utilizado en numerosas reacciones; principalmente como medio ácido, especialmente en las reacciones de oxido-reducción, o como un catalizador para acelerar diversos reacciones de síntesis; pero sus aplicaciones van más allá del laboratorio, ya que por sus características químicas, también ha encontrado un gran número de aplicaciones industriales, lo que le ha conferido una gran demanda entre el grupo de ácidos inorgánicos. Pero como ya les hablé un poco de sus características y usos más comunes, así que en esta oportunidad quiero compartir con ustedes algunas de las reacciones en las que el ácido sulfúrico es protagonista, con las cuales podremos conocer aún mejor las propiedades químicas de este versátil ácido.

Reacciones con metales
El ácido sulfúrico es un ácido diprotico de los más fuertes conocidos, que dependiendo de su concentración tiene diferentes usos, por los general participa en reacciones con metales y síntesis de compuestos, de hecho, por ser un buen agente oxidante, es capaz de oxidar casi todos los metales, con las únicas excepciones del oro, platino, rodio y el iridio.
Con ácido diluido
Cuando el ácido sulfúrico se encuentra suficientemente diluido en agua, reacciona con los metales más activos desprendiendo hidrogeno, veamos por ejemplo la reacción del magnesio en ácido sulfúrico diluido al 30% en las siguientes imágenes:

Reacción entre el ácido sulfúrico y una cnta de magnesio. Se puede observar un burbujeo intenso hasta disolverse la cinta. Fuente: @emiliomoron.
Como podemos apreciar la reacción es rápida y con abundante desprendimiento de gas. Sin embargo, este comportamiento no es igual para los metales menos activos. Si repetimos el mismo procedimiento pero ahora utilizando un pequeño trozo de cobre notaremos que no hay reacción.

Alambre de cobre sumergido en ácido sulfúrico diluido. No hay una reacción aparente. Fuente: @emiliomoron.
Al evaluar la actividad relativa de los metales estos se pueden ordenar en una fila como sigue:

El ácido sulfúrico puede reaccionar desprendiendo hidrogeno con los metales que se encuentran a la izquierda del hidrogeno en la fila, esta actividad decrece de izquierda a derecha, siendo el desplazamiento menos violento a medida que nos desplazamos a la derecha; y los metales que están después del hidrogeno en la fila a penas si logran desplazarlo, por lo que no hay una reacción aparente, lo que evidenciamos con el caso del cobre.
Con ácido concentrado
Si por el contrario, el ácido sulfúrico participa en la reacción con metales caliente y en alta concentración (>90%), actúa como un oxidante más fuerte y puede reaccionar con metales tanto activos como de baja actividad, pero bajo estas condiciones no produce desprendimiento de hidrogeno sino que reduce a H2S o SO2 dependiendo del tipo de metal con el cual reacciones. Veamos ahora la reacción entre el cobre y el ácido sulfúrico caliente:


Alambre de cobre sumergido en ácido sulfúrico concentrado y caliente. Ahora si se observa reacción. Fuente: @emiliomoron.
En la imagen podemos observar que la solución se va tornando de color azul, indicativo que bajo estas condiciones si ocurre una reacción, en la que el cobre ha pasado a la solución formando sulfato cúprico. También se podrá notar que no hay formación de burbujas. Quizás por la ocurrencia de un proceso secundario en la que se forma sulfato de cobre (I) y sulfuro cuproso.
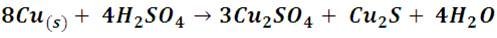
Esta diferencia de reactividad en el ácido sulfúrico según la concentración y la temperatura le permite ser usado a una relativa concentración y frio para remover capas de algún contaminante de las superficies metálicas de hierro o aluminio y cubrirlas de una capa de oxido estable en un proceso que se conoce como pasivación.
Reacción con agua
Ya les había comentado que además de ser un agente oxidante también es un fuerte agente deshidratante, por lo que en una elevada concentración se combina de forma violenta con el agua en una reacción exotérmica.
El calor liberado por esta reacción es lo suficientemente grande como para producir la ebullición del agua que entra en contacto con el ácido, por lo que una gota de agua que se deje caer sobre ácido sulfúrico concentrado es capaz de proyectarse fuera de la solución fuera por la formación inmediata de vapor de agua. Por lo que para preparar una solución de ácido sulfúrico siempre se debe verter el ácido sobre el agua y nunca lo contrario. Para no realizar un experimento que puede resultar peligroso podremos poner de manifiesto el calor de la reacción de hidratación agregando ácido sulfúrico a una concentración más baja sobre un poco de agua y medimos la temperatura de la solución.

En la secuencia de imagenes se puede apreciar el aumento de la temperatura de solución. Fuente: @emiliomoron.
Como podemos observar en las imágenes, se produce un aumento de la temperatura registrada por el conductimetro (de 28 a 36 ºC) luego de agregar algunas gotas de ácido al agua.
Reacción con azúcar
La capacidad de deshidratación del ácido sulfúrico también puede ponerse en evidencia con esta reacción. Al tener este ácido una gran capacidad oxidante, tiene una gran afinidad por el hidrogeno y el oxigeno de otros compuestos, ¿y qué compuesto tiene más de estos elementos que un carbohidrato?
Veamos por ejemplo lo que ocurre en las siguientes imágenes cuando agregamos una cucharada de azúcar en un volumen dado de ácido sulfúrico.

Secuencia de imagenes que muestra la deshidratación del azucar. Fuente: @emiliomoron.
En las imágenes se ilustra la deshidratación del azúcar hasta el punto de convertirla en carbón. Como vemos, la mezcla va ganando un color amarillo tostado que se va haciendo más intenso, en pocos minutos se notará el sólido marrón que va ganando volumen. En este caso el ácido utilizado no estaba muy concentrado, pero al utilizarse un ácido puro (98%) la reacción es rápida y produce la erupción de una columna de carbón que sobresale del vaso precipitado, pueden encontrar muchos videos en internet al respecto.
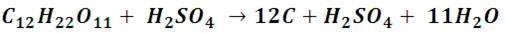
En la reacción se puede observar que la molécula de sacarosa es reducida a carbón puro y sólido. Lo que pone en evidencia la capacidad de este ácido para arrancar las moléculas de agua de un compuesto. Esta capacidad hace que el ácido sulfúrico sea muy reactivo frente a muchos materiales, como textiles, papel, la piel y las mucosas, es decir cualquier sustancia que puede contener hidrogeno y oxigeno para formar agua.
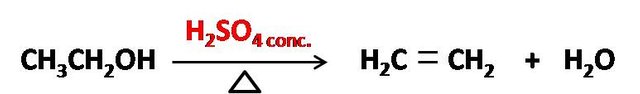
Pero esto que lo hace muy peligroso para el contacto con las personas, ya que al deshidratar tejido produce serias quemaduras, es de gran aplicación en la industria, ya que puede ser empleado como un agente deshidratante en diversos procesos industriales y de laboratorio. Por ejemplo, la deshidratación de alcohol etílico mediante ácido sulfúrico a alta temperatura es un proceso muy empleado para producir etileno, un gas muy utilizado como precursor de otros compuestos orgánicos.
Reacciones con sales
El ácido sulfúrico también resulta un excelente agente protonador, gracias a su alto grado de ionización, es muy utilizado para producir otros ácidos a partir de sus sales. Por ejemplo, mediante el tratamiento de sal común (cloruro de sodio) con ácido sulfúrico se obtiene cloruro de hidrogeno, que al disolverse en agua da como resultado ácido clorhídrico.
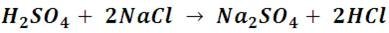
Otro ejemplo de una aplicación importante para este tipo de reacción es la producción de ácido nítrico (HNO3).
El ácido nítrico se puede preparar a partir de la reacción de la sal nitrato de potasio con el ácido sulfúrico caliente, como se describe en la siguiente reacción:

Aunque hoy día se obtiene el ácido nitrico mediante la oxidación de amoniaco en presencia de un catalizador, la obtención a traves de su sal con ácido sulfúrico es una vía economica y sencilla que aporta un buen rendmiento.
Reacciones electrolíticas
Debido a que el ácido sulfúrico es un ácido fuerte, también es un electrolito fuerte. Por ello es empleado en las baterías de los vehículos. Y no solo eso, existen numerosas aplicaciones donde se utilizan celdas electrolíticas que utilizan soluciones de ácido sulfúrico. Un experimento sencillo es la utilización de una solución diluida de ácido para provocar la electrolisis con un ánodo de sacrificio y producir la sal de sulfato de un metal.

Como observamos en la imagen, utilizando un ánodo de cobre y un cátodo de grafito, el cobre del ánodo comenzará a disolverse y a formar sulfato cúprico en solución (por eso la solución se va tornando de color azul), mientras que el metal de cobre comienza a depositarse en el cátodo.
 Imagenes de la electrolisis del cobre.La solución se va tornando azul y cobre metálico se deposita sobre el grafito. @emiliomoron.
Imagenes de la electrolisis del cobre.La solución se va tornando azul y cobre metálico se deposita sobre el grafito. @emiliomoron.Mediante un sistema similar, a nivel industrial se realiza la electrorefinación del cobre; proceso mediante el cual, en una celda electrolítica, el cobre se puede separar de sus impurezas (las cuales se quedan en torno al ánodo), disolviéndolo hacia la solución y recuperándolo en el cátodo.
Referencias
Enciclopedia Britanica. Sulfuric acid.
Hubpages.com (2018). Experiments with sulfuric acid.
MEL Science. Sulfuric acid and reactions with it.

Si desean consultar otros artículos de calidad en áreas de Ciencia, Tecnología, Ingeniería y Matemáticas (STEM, por sus siglas en inglés) en nuestro idioma español pueden hacerlo visitando la etiqueta #stem-espanol, también puedes realizar tus aportes, para ello revisa los criterios de curación y además la normativa para el uso de imágenes en la siguiente publicación: https://steemit.com/stem-espanol/@stem-espanol/presentacion-stem-espanol.

¡Felicitaciones!
Estás participando para optar a la mención especial que se efectuará el domingo 30 de junio del 2019 a las 8:00 pm (hora de Venezuela), gracias a la cual el autor del artículo seleccionado recibirá la cantidad de 1 STEEM transferida a su cuenta.
¡También has recibido 1 ENTROKEN! El token del PROYECTO ENTROPÍA impulsado por la plataforma Steem-Engine.
Te participamos que puedes invertir en el PROYECTO ENTROPÍA mediante tu delegación de Steem Power y así comenzar a recibir ganancias de forma semanal transferidas automáticamente a tu monedero todos los lunes. Entra aquí para más información sobre cómo invertir en ENTROPÍA.
Contáctanos en Discord.
Apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
Puedes consultar el reporte diario de curación visitando @entropia.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Gracias equipo de @entropia
This post has been voted on by the SteemSTEM curation team and voting trail. It is elligible for support from @curie and @utopian-io.
If you appreciate the work we are doing, then consider supporting our witness stem.witness. Additional witness support to the curie witness and utopian-io witness would be appreciated as well.
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
Please consider setting @steemstem as a beneficiary to your post to get a stronger support.
Thanks for having used the steemstem.io app. You got a stronger support!
Thanks for the support!
Hi @emiliomoron!
Your post was upvoted by Utopian.io in cooperation with @steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
Many thanks!
Sin lugar a dudas es uno de los ácidos más usados como mencionas! las fotos son muy buenas, felicidades por el gran trabajo que realizas en tu área