ANTIÁCIDOS BASADOS EN HIDROCALUMITAS CARBONATADAS SINTETIZADAS MEDIANTE MICROONDAS.
Fundamento teórico
Los antiácidos son sustancias que son capaces de de incrementar el pH ácido del estómago hasta un pH donde la sensación de ardor es disminuida (generalmente alrededor de 5). Esta sensación es causada por algunas situaciones de stress, mala nutrición o por efecto de algunas enfermedades.
Muchos son los antiácidos existentes en el mercado, tales como: carbonatos, bicarbonatos, hidrotalcitas, óxidos de aluminio o magnesio, u óxidos mixtos de aluminio y magnesio. Todos ellos tienen ventajas y desventajas, que van desde su costo hasta la eficacia y mantenimiento del pH en cada individuo.
En nuestro laboratorio hemos sintetizados, caracterizados y probados in vitro diversos tipos de antiácidos, algunos de ellos son de origen natural y otros son sintéticos. En este caso, tomaremos en cuenta un antiácido formulado con hidrocalumitas carbonatadas sintetizadas eficientemente mediante un horno doméstico.
Las hidrocalumitas son minerales sintéticos o naturales, muy cercanas a las hidrotalcitas. Son clasificadas como arcillas aniónicas de fórmula (Ca2M3+(OH)6)(An-)1/n.mH2O], donde M3+ es el catión Al3+, y An- es el anión carbonato. La relación Ca2+/Al3+ está fija en dos.
Debido a sus propiedades básicas, este tipo de mineral puede ser utilizado como antiácido (Figura 1).

Fig. 1. Hidrocalumita. Wikimedia commons.
La síntesis de las hidrocalumitas se lleva a cabo frecuentemente mediante el método de co-precipitación usando sales solubles de calcio y aluminio en un medio básico, y un anión, que generalmente es nitrato o cloruro. Cuando se desea preparar hidrocalumitas de carbonato, se adiciona en el medio de reacción, alguna sales solubles de carbonato, tal el como el carbonato de sodio, pero la adición y tiempo de reacción debe ser cuidadosamente controlada a fin de evitar la formación de carbonato de calcio, el cual es una fase no deseada en la síntesis de este compuesto.
Una manera eficaz de sintetizar la hidrocalumita de calcio en un corto tiempo, es mediante el uso de microondas. El microondas permite el ahorro, no solo de energía, sino de tiempo.
Sección experimental
Síntesis de hidrocalumita carbonatada.
La hidrocalumita carbonatada fue sintetizada según el procedimiento descrito por López-Salinas et al. En general, se preparan dos soluciones Al(NO3)3•9H2O y Ca(NO3)2•4H2O en agua destilada. Esta solución se añade lentamente sobre una solución de NaOH y Na2CO3. El gel formado se coloca en un recipiente de teflón el cual se introduce en un horno microondas doméstico (120 V, 2450 MHz, 1250 W y 60 Hz de poder) por 2,5 min. Después del calentamiento, el sólido fue sacado del horno microondas y lavado con abundante agua destilada hasta alcanzar un pH cercano 7. En la figura 2, se detalla un esquema de la síntesis de este material.
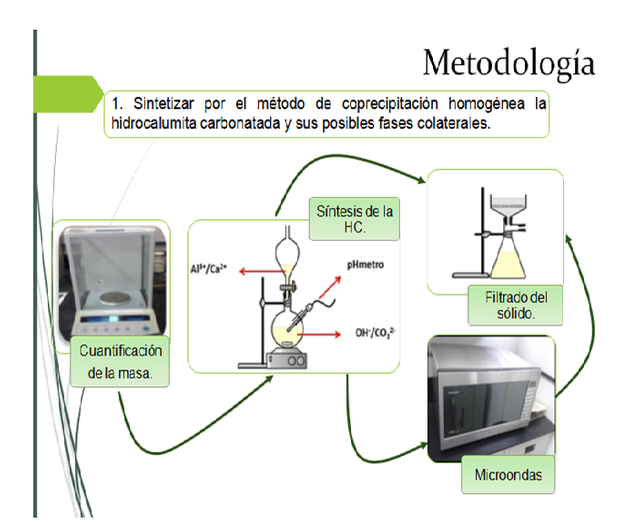
Fig. 2. Esquema de síntesis de la hidrocalumita. Lámina de powerpoint. Fuente propia.
Caracterización de la hidrocalumita
La hidrocalumita carbonatada fue caracterizada por diversas técnicas tales como: difracción de rayos X, medidas de superficie, microscopia electrónica de barrido y espectroscopia de infrarrojo con transformada de Fourier. Los resultados no serán presentados en este artículo, pero están a disposición de los interesados.
Capacidad antiácida
La capacidad antiácida de la hidrocalumita carbonatada sintetizada mediante el uso de un horno microondas fue llevado a cabo usando la metodología reportada por Linares et al. De 30 a 150 mg de la hidrocalumita fueron puestos en contacto con 10 mL de un jugo gastrico sintético (HCl + pepsina, pH» 1.5). El sólido dispersado fue agitado durante una hora a 37 °C para similar los movimientos rítmicos del estómago. Luego, a la solución filtrada se le determinó el pH usando un potenciómetro calibrado. Un antiácido comercial a base de carbonato fue usado como referencia.
Resultados y su discusión
Los resultados de la caracterización confirmaron la estructura deseada. Algo muy interesante a señalar fue el tiempo de reacción para obtener esta estructura usando el método de microondas: 2,5 min fueron suficiente; mientras que la síntesis de hidrocalumitas, usando el método tradicional, abarca hasta 6 horas de reacción, lo que implica una disminución de tiempo de reacción bastante importante.
Por otra parte, en la figura 3 se puede observar la capacidad antiácida de la hidrocalumita carbonatada sintetizada y un antiácido comercial. Tal como se puede observar para ambos sólidos, a medida que aumenta la masa de material, aumenta el pH de la solución. Luego, ya para masas superiores a los 100, se alcanzan pH superiores a 6, esto no es conveniente porque, si bien el alivio estomacal es rápidamente controlado, se cae en riego de que el paciente sufra del llamado “efecto rebote” que consiste en una repuesta rápida del organismo a disminuir el pH estomacal volviendo a provocar una mayor acidez. El pH ideal debe estar entre 5 y 6 unidades de pH.
Para el compuesto comercial, este pH ideal se alcanzó con casi 100 mg de sólido, mientras que en el caso de la hidrocalumita, sólo fue necesario 75 mg, lo cual cataloga a la hidrocalumita carbonatada como un mejor antiácido que el compuesto comercial.
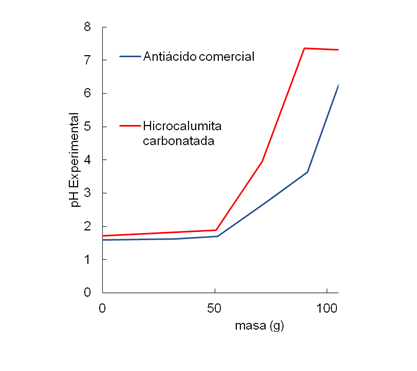
Fig. 3. Capacidad antiácida de la hidrocalumita y un compuesto comercial. Fuente propia.
CONCLUSIONES
- Es posible la síntesis de la hidrocalumita carbonatada usado radiación microonda en un tiempo corto de síntesis 2,5 min.
- Esta hidrocalumita carbonatada resultó ser más eficiente como antiácido que un antiácido comercial
REFERENCIAS
- M. Sánchez-Cantú, L.M. Pérez-Díaz, N. Tepale-Ochoa, V.J. González-Coronel, M.E. Ramos Cassellis, D. Machorro-Aguirre, J. Valente, Fuels 110, 23, (2013)
- R. Segni, L. Vielle, F. Leroux, C. Taviot-Guèho, J. Phys. Chem. Solids, 67, 1037, (2006)
- E. López-Salinas, M.E. Llanos-Serrano, M.A. Cotés-Jácome, I. Schifter-Secora, J. Porous Mater. 2, 29, (1996)
- C.F. Linares, F. Ocanto, P. Bretto, M. Monsalve, Bull. Mater. Sci. 37, 341, (2014)
- M. Mora, M.I. López, C. Jiménez-Sanchidrián, J.R. Ruiz, J. R. Catal. Lett. 136, 192, (2010)
- R. Frost, S. Palmer, F. Theiss, J. Raman Spectrosc. 42, 1163, (2011)
- C. F. Linares, J. Moscosso, V. Alzurutt, F. Ocanto, P. Bretto, G. González, J. Chil. Chem. Soc. 41, 41 (2018)
Congratulations @clinares! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
Click here to view your Board of Honor
If you no longer want to receive notifications, reply to this comment with the word
STOPDo not miss the last post from @steemitboard:
Congratulations @clinares! You received a personal award!
You can view your badges on your Steem Board and compare to others on the Steem Ranking
Vote for @Steemitboard as a witness to get one more award and increased upvotes!