Demostración del proceso de Estandarización o Neutralización Ácido Base, para determinar las concentraciones de las soluciones que preparamos en casa |Área: Reacciones Químicas |
Solución Básica de Hidróxido de Sodio (NaOH)

Neutralización o Estandarización Ácido Base.
Una Estandarización ácido-base, también llamada titulación ácido-base, volumetría ácido-base, equivalente de neutralización y valoración, es una técnica de análisis cuantitativo usada, que mediante ella podemos conocer la concentración de una sustancia que pueda ser un ácido que será neutralizada por una base de concentración conocida, o bien sea por medio de una concentración de base desconocida que será neutralizada por un ácido conocido. Este tipo de valoración se basa en una reacción de neutralización entre el analito, que no es más que la sustancia cuya concentración deseamos conocer y la sustancia valorante.
Es decir; que podemos determinar la concentración de una sustancia por medio de otra conocida, cuando alcanzamos la neutralización de la solución, ósea, cuando los moles del ácido se igualan a los moles de la base o que es lo mismo cuando todos los moles del ácido reaccionan con todos los moles de la base para formar una sal, y es allí cuando se conoce como el punto de equivalencia de la sustancia.
Neutralización o Estandarización Ácido Base con Fenolftaleína

Proceso de Neutralización o Estandarización del NaOH con H2SO4.
Para la titulación del Hidróxido de Sodio (NaOH), que es una base fuerte, se debe utilizar un ácido fuerte en este caso el Ácido Sulfúrico (H2SO4), que neutralice la base de NaOH. Para ello necesitaremos observar el punto de neutralización o de equivalencia por medio de un indicador que en cuanto a sus cambios de color debido a los intervalos de pH de la solución nos muestre el preciso momento en que la solución allá reaccionado por completo los moles del ácido con la base, dándonos así el color característico de la estandarización.
Proceso de titulación o neutralización del NaOH con H2SO4

Para ello es necesario utilizar una bureta que nos permita agregar gota a gota de la solución valorante, para que así sea más exacta y se pueda observar el punto de equivalencia. Así como la preparación de ambas soluciones tanto del ácido como de la base, si la misma está muy concentrada se deben diluir lo necesario para no gastar tanto reactivo titulante. En este caso la solución de hidróxido de sodio se diluyo 1.5 mililitros en 3 litros de agua, que posteriormente se agregaron 10 mL de esta solución en el Erlenmeyer donde se titularía y la solución de H2SO4 estaba previamente estandarizada a 0.05 Molar (Mol/Litro), que es la solución de referencia.
Esquema de preparación de las soluciones y titulación

Para esta demostración implementaremos como indicador de preferencia por ser acido base, la Fenolftaleína, que en medio ácido no reacciona o que es lo mismo no presenta color, por otro lado este indicador cuando se encuentra en medio básico posee un color fucsia característico. En cambio cuando la solución se encuentra en un punto neutro, es decir que se llegó al punto de equivalencia, se debe buscar el momento en que la solución cambia de fucsia a transparente.
Colores indicadores de la Fenolftaleína según el pH

Sabiendo todo lo referente al indicador, y los fundamentos de la estandarización procedemos a visualizar la demostración práctica del método.
Video del proceso de estandarización del NaOH con H2SO4
Calculo de la concentración inicial del NaOH
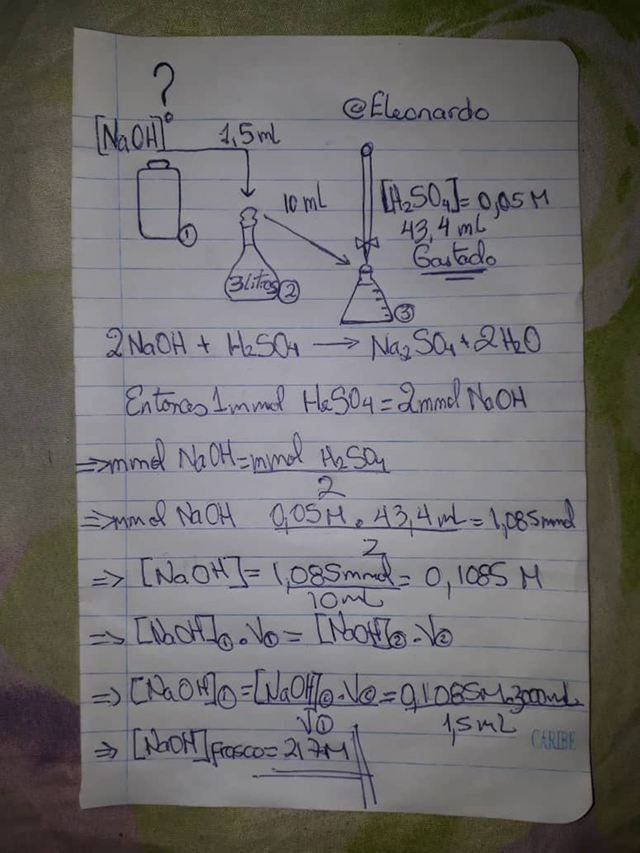
Para nuestra concentración inicial de NaOH encontrada es de 217 molar, lo que es justificada, ya que se tenía en escamas pero debido a una mala manipulación el NaOH absorbió humedad y se volvió una solución muy concentrada tanto así que se tuvo que disolver un poco más ya que la misma estaba sobre saturada debido a la evaporación del agua y estaba precipitando en cristales. También podemos usar esta solución para determinar la concentración por ejemplo del Ácido sulfúrico que se usa para las baterías de carro el cual el fabricante no proporciona dicha información.
Hidróxido de Sodio concentrado

A veces tenemos líquidos o soluciones que las agregamos a otra para preparar algo y simplemente lo hacemos al ojo porciento creyendo que todo resultara bien y cuando lo probamos vemos como esa solución nos reseca la piel o nos irrita, bien sea porque nos pasamos de ácido o de base, afectando el pH de nuestro producto final. Por eso es importante siempre tener estas nociones básicas para controlar las concentraciones finales de lo que deseamos, la química es exacta y perfecta, los colores son hermosos y las moléculas son misteriosas como trabajan en el submundo microscópico de la química de las reacciones.
Hasta pronto
Get your post resteemed to 72,000 followers. Go here https://steemit.com/@a-a-a
Hello and excellent friend techniques, which help us to put into practice when doing any work at home. Thanks for the information, regards.
thank you friend for visiting my article! If it is a method of basic chemistry, which allows us to achieve the concentrations of solutions at home. regards
no te da verguenza dejar comentarios como este pedazo de hija de puta caradetabla?
Excelente! un gran aporte sin duda alguna!
gracias mi compañera! espero que siempre mis artículos sean de tu agrado!
Quimica basica, pero necesaria para llevar a cabo grandes procesos industriales y sobretodo de investigación.
muy cierto amigo, química básica nuestro pan de cada día.
Excelente toda la información y la experimentación realizada estimado Leo, ya se te extrañaba por aquí.
epale hermano saludos, si estuve algo distanciado por motivos personales pero ya estoy de regreso y listo para exponer los conocimientos!
Hi @eleonardo!
Your post was upvoted by utopian.io in cooperation with steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
A pesar de ser química básica, no entendí ni un poco!
jajaja próximamente explicare mas detallado los calculos.
Una técnica muy útil y necesaria para todo trabajo que requiera el uso de soluciones en el laboratorio. Saludos amigo
si ese es el pan de cada dia en un laboratorio! gracias por visitar el articulo.
Interesante Post, lejos de lo que la mayoria cree, las titulaciones no solo son utiles en laboratorios de quimica, en laboratorios de analisis biologico suelen ser muy utiles, pero se emplea mucho mas la unidad de concentracion de Normalidad, que aunque puede ser un dolor de cabeza calcularla, resulta de mucha utilidad. Si en un post pudieras hablar sobre eso seria fantastico.
si de hecho todo estaba preparado en normalidad, la solucion de acido estaba a 0.1 N si mal no recuerdo. solo que es mas complicado para muchos en esas unidades para trabajar y las cambie. seguro pronto te lo hare.
Se agradecen estos aportes al aprendizaje de la química. Felicitaciones @eleonardo
gracias tomas saludos!