EL MUNDO MICROSCÓPICO DE LA QUÍMICA

La química siempre la relacionamos de una manera u otra con estas especies.
Demócrito. (Filósofo griego), expreso la idea de que toda la materia estaba formada por muchas partículas pequeñas e indivisibles que llamo átomos (que significa, indestructible o indivisible). A pesar de que la idea de Demócrito no fue aceptada por muchos de sus contemporáneos como Aristóteles y Platón. Las evidencias experimentales de algunas investigaciones científicas apoyaron el concepto de “atomismo”.
En 1808, John Dalton, formulo una definición precisa de las unidades indivisibles con las que está formada la materia y que llamamos átomos.
Este trabajo marco el principio de la era moderna de la química o química moderna. Su teoría puede resumirse como, Los elementos están formados por partículas extremadamente pequeñas llamadas átomos. Todos los átomos de un mismo elemento son idénticos, tienen igual tamaño, masa y propiedades químicas. Los átomos de un elemento son diferentes a los átomos de todos los demás elementos.
Los compuestos están formados por átomos de más de un elemento. En cualquier compuesto, la relación de numero de átomos entre dos de los elementos presentes siempre es un numero entero o una fracción sencilla. Una reacción química implica solo la separación, combinación o reordenamiento de los átomos, nunca supone la creación o destrucción de los mismos. La estructura del átomo con base en la teoría atómica de Dalton, un átomo se define como la unidad básica de un elemento que puede intervenir en una combinación química. Posteriores investigaciones demostraron que los átomos están formados por partículas aún más pequeñas, llamadas partículas subatómicas, investigaciones condujeron al descubrimiento de tres partículas como, electrones, protones y neutrones.
El electrón
Mientras estudiaba el comportamiento de los rayos catódicos. J.J Thomson comprobó que en el tubo de rayos catódicos existían unas partículas con carga negativa a estos los denomino corpúsculos. Posteriormente, George Stoney había propuesto la existencia de estas partículas, pero no había podido comprobarla. Como asumía que la partícula tenia carga eléctrica la denomino electrón, pero a esta había que medir sus propiedades en particular su carga eléctrica, R. Millikan con un experimento llamado “de la gota de aceite” logro conocer sus propiedades.
El protón y el núcleo
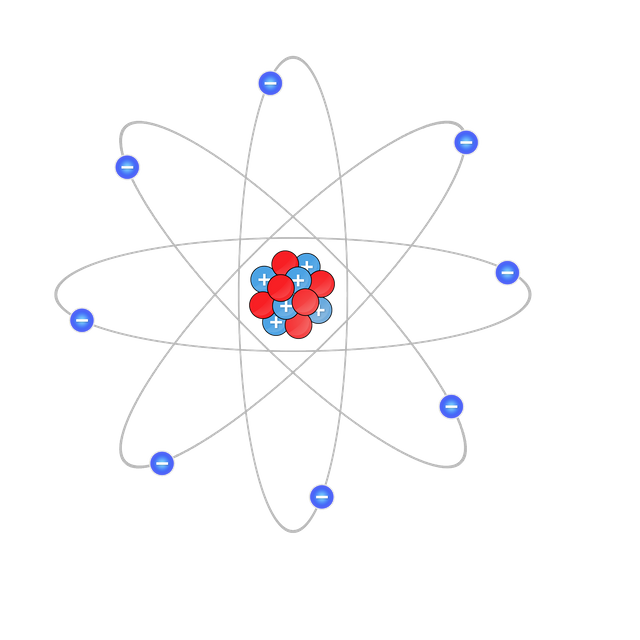
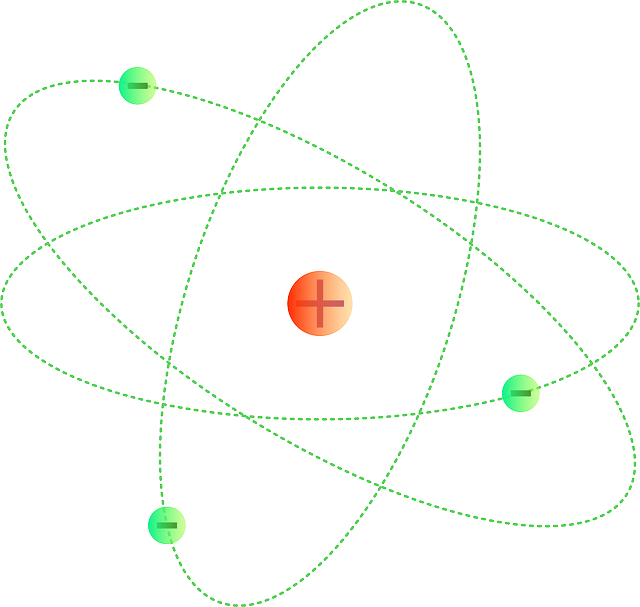
Ya se conocían dos características de los átomos, contienen electrones y son eléctricamente neutros. Para que un átomo sea neutro debe conectar el mismo de cargas positivas. Thomson propuso que un átomo podía visualizarse como una esfera uniforme cargada positivamente, dentro de la cual se encontraban los electrones como si fueran las pasas en un pastel. este modelo llamado “modelo del budín de pasas”, se aceptó como una teoría durante algunos años. Rutherford, que estudio con Thomson en la universidad, utilizo partículas α para demostrar la estructura de los átomos. Este realizo una serie de experimentos utilizando laminas muy delgadas de oro y de otros metales, como blanco de partículas α provenientes de una fuente radiactiva. El observo que la mayoría de las partículas atravesaban las láminas sin desviarse o bien con una ligera desviación. Rutherford propuso que las cargas positivas de los átomos estaban concentradas en un denso conglomerado central dentro del átomo, que llamo núcleo. Cuando una partícula α pasaba cerca del núcleo en el experimento, actuaba sobre ella una gran fuerza de repulsión, lo que originaba una gran desviación. Más aun cuando una partícula α incidía directamente sobre el núcleo, experimentaba una repulsión tan grande que su trayectoria se invertía por completo.
Las partículas del núcleo tienen carga positiva reciben el nombre de protones. En otros experimentos se encontró que los protones tienen la misma cantidad de carga que los electrones y que su masa es de 1.67262x10-24g, aproximadamente 1840 veces la masa de las partículas con carga negativa, los electrones.
El neutrón
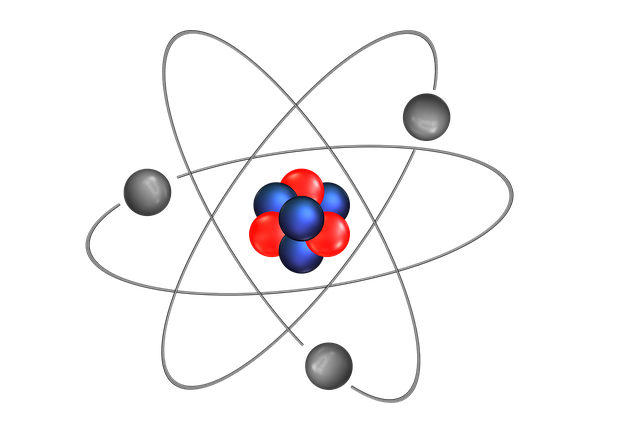
El modelo de Ritherford de la estructura atómica dejaba un importante problema son resolver. Se sabía que el hidrogeno, el átomo más sencillo, contenía solamente un protón y que el átomo de helio contenía dos protones. Por tanto, la relación entre masa de un átomo de helio y un átomo de hidrogeno debería ser 2:1. (debido a que los electrones son mucho más ligeros que los protones, se puede ignorar su distribución a la masa atómica.) sin embargo, en la realidad la relación es 4:1. Rutherford y otros investigadores habían propuesto que debería existir otro tipo de partícula subatómica en el núcleo, hecho que el físico Chadwick probo. Experimentos posteriores demostraron que esos rayos realmente constan de un tercer tipo de partícula subatómicas, que Chadwick llamo neutrones debido a que se demostró que eran partículas eléctricamente neutras con una masa ligeramente mayor que la masa de los protones. El misterio de la relación de las masas ahora podía explicarse. En el núcleo de helio existen dos protones y dos neutrones. Mientras que en el núcleo de hidrogeno hay solo un protón y no hay neutrones, por tanto, la relación es 4:1.
Moléculas e iones
De todos los elementos, solo los seis gases nobles del grupo 8ª de la tabla periódica (He, Ne, Ar, Kr,Xe y Rn) existen en la naturaleza como átomos sencillos. Por esta razón se dice que son gases monoatómicos (lo que significa un solo átomo). La mayor parte de la materia está compuesta por moléculas o iones formados por los átomos.
Moléculas
Una molécula es un agregado de por lo menos dos átomos en una colocación definitiva que se mantienen unidos a través de fuerzas químicas también llamadas enlaces químicos. Una molécula puede contener átomos del mismo elemento o átomos de dos o más elementos, siempre en una proporción fija, de acuerdo con la ley de las proporciones definidas. Así, una molécula no siempre es un compuesto, el cual, por definición está formado por dos o más elementos.
Iones
Un ion es un átomo o un grupo de átomos que tiene una carga neta positiva o negativa. El número de protones, cargados positivamente, del núcleo de un átomo permanece igual durante los cambios químicos comunes llamados reacciones químicas, pero se pueden perder o ganar electrones, cargados negativamente. La pérdida de uno o más electrones a partir de un átomo neutro forma un catión un ion con carga positiva. Por ejemplo, un átomo de sodio (Na) fácilmente puede perder un electrón para formar el catión sodio, que se representa como Na+ . Por otra parte, un anión es un ion cuya carga neta es negativamente debido a un incremento en el número de electrones. Por ejemplo, un átomo de cloro (Cl) puede ganar un electrón para formar el ion cloruro Cl-.
Formulas químicas
Los químicos utilizan las formulas químicas para expresar la composición de las moléculas y los compuestos iónicos, por medio de los símbolos químicos. Composición significa no solamente los elementos presentes, sino también la proporción en la cual se combinan los átomos. Es necesario familiarizarse con dos tipos de fórmulas, formulas moleculares y empíricas.
Resumen
Un átomo está constituido por un núcleo central muy denso que contiene protones y neutrones y por electrones que se mueven alrededor del núcleo a una distancia relativamente grande. Los protones están cargados positivamente, los neutrones no tienen carga y los electrones están cargados negativamente. Los protones y neutrones tienen aproximadamente la misma masa. En las formulas químicas se combinan los símbolos de los electrones que las forman, utilizando como subíndices números enteros para indicar el tipo y número de átomos contenidos en la unidad más pequeña de un compuesto
Referencia
Chang, Raymond Química, 6ª ed McGraw-Hill, México, 1999. Pg 55
Congratulations @erwinjose! You received a personal award!
Click here to view your Board of Honor
Congratulations @erwinjose! You received a personal award!
You can view your badges on your Steem Board and compare to others on the Steem Ranking
Vote for @Steemitboard as a witness to get one more award and increased upvotes!