LA FÍSICA ES DIVERTIDA: PARTE 8
La ruta del aire: compresión y descompresión térmica
Hola de nuevo a todos, apreciados colegas y amigos de STEEMIT. En el Capítulo 7 de “La Física es Divertida” nos centramos en una inquietud generada a partir de mis intereses ambientalistas. En particular, la contaminación de aguas por acumulación de desechos sólidos, tales como el plástico y el anime. Les mostré que este tipo de contaminación ambiental satisface ciertas leyes físicas y principios básicos: Principio de Arquímedes, Efecto Venturi y presencia de fuerzas de adhesión.
Si te perdiste este Capítulo así como los anteriores, puedes revisarlos en los siguientes enlaces:
En mis cursos de Física básica siempre realizo a los estudiantes preguntas sencillas sobre los fenómenos cotidianos y de su entorno. Algunas de esas preguntas son:
Con la finalidad de hacer este proyecto más interactivo, les agradezco dejarme sus inquietudes y preguntas en un REPLAY, y así darles respuesta.
Para más información sobre este tema y otros relacionados con Ciencia, Física y Tecnología, les invito visitar mis sitios:
Introducción
Siendo el aire y el agua los compuestos más abundantes en La Tierra, y que son responsables de la vida en el Planeta, deberíamos tener conciencia sobre sus propiedades más elementales. En el caso del aire, es un gas compuesto por 78% de nitrógeno, 21% de oxígeno y 1% de otros elementos, incluyendo el vapor de agua. Tiene propiedades mecánicas, ópticas, termodinámicas e hidrostáticas. Las llamadas “Ciencias Atmosféricas” se basan en el estudio de las propiedades del aire. Aparte de esto, es el canal ideal para la propagación de señales de radio, microondas y de sonido.
En primera instancia el aire se considera un gas ideal, sin embargo bajo ciertas circunstancias su comportamiento es gobernado por la ecuación de estado de un gas real. El aire es un fluido viscoso y dispersivo, además un gas compresible, es decir, se expande y se comprime. Pero, ¿cómo almacenar aire en tu casa, comprimirlo y descomprimirlo sin tener los equipos apropiados?.. Antes de concentrarnos en este objetivo, debemos conocer los principios físicos que gobiernan el comportamiento de un gas: la Ecuación de Estado.
Acompáñame ahora a través de la “ruta del aire”, donde discutiremos la física básica que gobierna su comportamiento.
Gas ideal y gas real: ecuación de estado
Un gas es un estado de agregación de la materia, en el cual sus moléculas interaccionan tan débilmente que se pueden despreciar los enlaces inter-moleculares. Las propiedades de los gases han sido uno de los objetos de estudio más importantes de los científicos del S. XVII hasta nuestros tiempos. El reto primordial siempre ha sido la descripción teórica y experimental del comportamiento P-V-T (presión-volumen-temperatura) del gas. Desde el punto de vista termodinámico definimos estas variables de la siguiente manera:
Presión (N/m2, atm, bar): fuerza aplicada por las partículas del gas al chocar contra las paredes del contenedor. Presión constante implica que no hay intercambio de partículas.
Volumen (Litro, cc, m3): espacio ocupado por el gas. Volumen constante implica que el gas ocupa el mismo espacio, sin importar las condiciones.
Temperatura (Kelvin): grado de agitación de las moléculas del gas al absorber energía en forma de calor. Las variaciones de temperatura modifican el estado de energía cinética del gas. Temperatura constante implica que la energía cinética es constante.
El punto de partida para los químicos y físicos precursores en el estudio de los gases, fueron los dos sistemas primordiales:
1. Sistema de partículas idénticas con interacciones moleculares nulas o despreciables (gas ideal)
2. Sistema de partículas idénticas con interacciones moleculares no despreciables (gas real)
En la Figura 1 muestro los modelos básicos de un gas ideal y un gas real
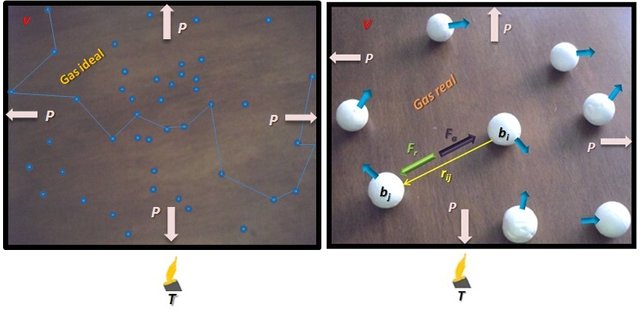
Figura 1. Modelo de gas ideal y de gas real idealizados por científicos pioneros en termodinámica de gases. (Figura original del Autor)
Un gas ideal está formado por partículas de masa finita, M, pero de volumen pequeño con relación al volumen total que ocupa el gas, V. Las partículas se mueven siguiendo trayectorias aleatorias (líneas azules) interaccionando vía colisiones elásticas, sin pérdidas de energía. Hemos observado a diario que al calentar un envase con un gas, este se expande aumentando también la presión dentro del envase. Debido a que no hay fuerzas intermoleculares, cualquier aumento de la presión sobre el gas, producirá que el gas se comprima y en consecuencia, disminuye el volumen ocupado.
Estas observaciones se resumen en tres leyes empíricas clásicas, para gases a baja densidad:
Ley de Robert Boyle (1627-1697). Establece que cuando un gas ocupa un volumen, V, a determinada presión, P, y temperatura constante, T0, se debe cumplir que,

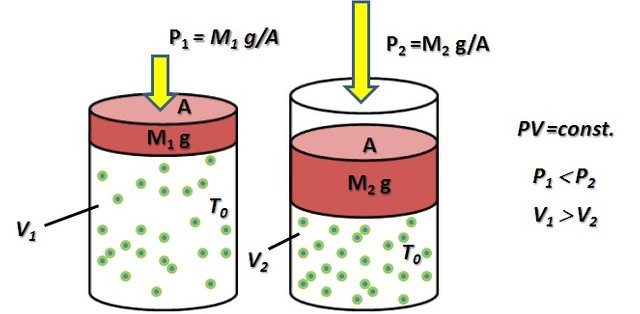
Figura 2. Esquema gráfico para comprender la Ley de Boyle, PV=const. (Figura original propiedad del Autor).
Ley de Jacques Charles (1746-1823). Establece que cuando un gas ocupa se encuentra a presión constante, P0, el volumen del gas, V, y temperatura, T, satisfacen la relación de proporcionalidad

En la Figura 3, se esquematiza la Ley de Charles. Esto implica que si la temperatura aumenta, por consiguiente el volumen también aumenta.
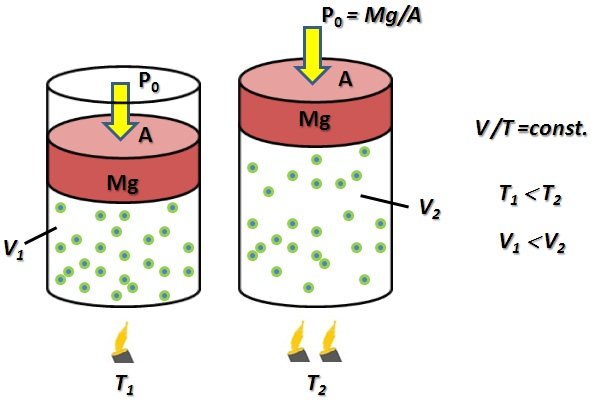
Figura 3. Esquema gráfico para comprender la Ley de Charles, V/T=const. (Figura original propiedad del Autor).
Ley de Gay-Lussac (1778-1850). Si el volumen ocupado por el gas es constante, la presión, P, y temperatura, T, cumplen la relación)

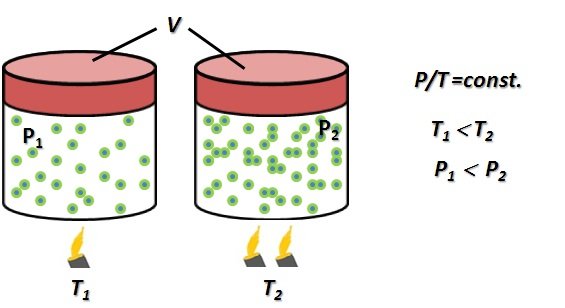
Figura 4. Esquema gráfico para comprender la Ley de Charles, V/T=const. (Figura original propiedad del Autor).


donde “n” es la cantidad de substancia en moles y R=8.3145 J mol-1K, es la constante universal de los gases. Esta es la Ecuación de Estado de los gases ideales. Si la cantidad de substancia es igual al número de Avogadro (NA), el producto NAR es igual a la famosa constante de Boltzmann (KB = 1.38 x 10-23 J K-1 = 0.8625 x 10-4 eV K-1 ). A la Ecuación (5) también se le llama Ecuación de Clapeyron-Mendeleev quienes la derivaron teóricamente utilizando argumentos estadísticos.
Como consecuencia de estas leyes fundamentales, si los procesos de compresión-descompresión o de intercambio de energía térmica ocurren entre varios estados de equilibrio sucesivos, obtenemos las relaciones de recurrencia,



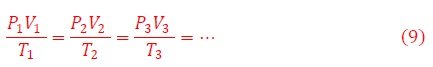
La pregunta fundamental en este punto es: ¿Todos los gases satisfacen estas ecuaciones? ¿Qué ocurre si las fuerzas intermoleculares del gas se activan?. Veamos.
El problema real es complicado, ya que se trata de un problema de muchos cuerpos bajo la acción de fuerzas de atracción/repulsión. Pero ¿cómo son estas fuerzas?. Existen diversos modelos teóricos que intentan explicar el comportamiento de un gas real para determinadas condiciones de P-V-T. Un gas real consiste en un arreglo de moléculas de volumen bi, y volumen efectivo B=∑bi. Las molécula se mueven en direcciones diferentes (flechas azules), e interactúan entre sí a través de la acción de fuerzas de atracción, Fa, y repulsión, Fr, cuyas intensidades y rango de acción dependen de la distancia intermolecular rij. Si se encierra este gas en un recipiente de volumen V sometido a una temperatura T, las moléculas del gas ejercerán una presión P sobre las paredes del recipiente. La ecuación de estado de éste gas viene dada por,

donde A es una constante positiva relacionada con las fuerzas intermoleculares (N/m2. L2). Esta es la ecuación de van der Waals que estudiamos en nuestros cursos de termodinámica. La derivación formal de la Ecuación de van der Waals escapa del objetivo central de este “post”, pero puede encontrarse en cualquier texto de “Física Estadística” o “Termodinámica”.
En la Figura 5 mostramos gráficamente la dependencia P (V, T) para el aire (A=1.31 atm L2 y B=0.03 L) a dos temperaturas genéricas T1 y T2=0.75 T1. Las líneas punteadas corresponden a la ecuación de estado del gas ideal a las mismas temperaturas. La línea horizontal indica un valor constante presión. Obsérvese que a partir de cierto volumen crítico, VC, el gas real se aproxima al gas ideal. Manteniendo la presión constante se observa en ambos casos, que el volumen disminuye al disminuir la temperatura. Por debajo de VC el gas muestra un comportamiento anómalo, en el cual la presión aumenta dramáticamente con pequeños incrementos en el volumen. Por encima de este volumen crítico, el gas real presenta un comportamiento de gas ideal.
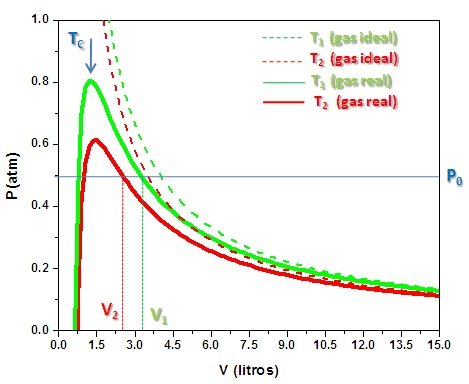
Figura 5. Ecuación de estado para un gas de van der Waals. Las curvas punteadas corresponden al gas ideal. (Figura original propiedad del Autor).
Experimento
Les quiero presentar un caso de compresión-descompresión térmica que ocurre todo el tiempo en nuestros propios ojos, pero que no le prestamos suficiente atención:
Probablemente están muy ocupados para prestarle un poco de atención al fenómeno. Pero mi tarea es observar todo lo que ocurre a mi alrededor, y explicarlo a Uds. con ayuda de las leyes divinas de la Naturaleza. A continuación les muestro algunas de mis observaciones con un gas llamado aire.
Para la tarea que les propongo a continuación solo necesitan envases de refresco de 1.5 L con sus tapas, una nevera o congelador, un termómetro de cocina y un cronómetro (celular). Ahhhh y por supuesto bastante aire…

Figura 6. Materiales básicos usados en la demostración del envase plástico en el congelador (Fotografía propiedad del Autor: tomada con una cámara digital CASIO Exilim 12.1 Mega Pixels).
Primero veamos si es verdad que un gas frío se contrae. Coloca en el congelador de tu casa un envase de refresco sin su tapa, junto al termómetro. Espera unos minutos hasta que la temperatura alcance una temperatura cercana a 0°C (273 K). En un congelador bien ajustado serán aproximadamente 10 minutos.
Luego de este tiempo saca el envase de refresco del congelador y compáralo con el envase a temperatura ambiente. El envase conservó su volumen, y no se comprimió como era de esperarse… ¿No es así?... ¿Puedes explicar porqué no pasó nada?...

Figura 7. Cuando un envase vacío está abierto, el aire dentro no se comprime al enfriarse (Fotografía propiedad del Autor: tomada con una cámara digital CASIO Exilim 12.1 Mega Pixels).
Ahora repite la experiencia pero con el envase de refresco cerrado (con la tapa). Veamos que tenemos luego del enfriamiento. Recuerda colocar el termómetro dentro del congelador y registrar la temperatura.
Como te pudiste dar cuenta, el envase de plástico se comprimió, cómo era de esperarse, pero… ¿Porqué al tapar el envase ocurrió la compresión?...¿Puedes explicar lo que ocurrió?...¿Saca el envase del congelador. Al calentarse este se descomprime y recupera su volumen?...Y lo más importante:

Figura 8. Cuando se enfría un envase cerrado, el aire dentro se comprime y el volumen disminuye (Fotografía propiedad del Autor: tomada con una cámara digital CASIO Exilim 12.1 Mega Pixels).
Explicación
En esta sección intentaré explicarles de manera simple lo que acaban de ver. En el primer caso, con el envase está abierto, permitimos el intercambio de aire frío y caliente de tal manera que a medida que baja la temperatura, la presión disminuye de acuerdo con la relación (8)
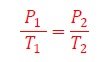
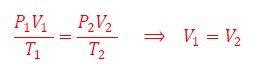
El envase no se comprime. Ahora bien, veamos la Ecuación de estado del gas real (10), antes y después del enfriamiento,
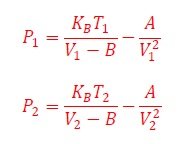
Observamos del gráfico de la Figura 5, que cuando un gas real se enfría su presión disminuye, es decir P2 ‹ P1, ó, equivalentemente,
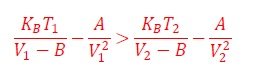
Esta desigualdad tiene dos soluciones reales posibles: 1) V1=V2; 2) V2 ‹V1. Sin embargo, segunda condición conduce a presiones negativas, por lo tanto, la solución aceptable es V1=V2, es decir, no hay compresión.
En el segundo caso colocamos en el congelador el mismo envase con su tapa. Veremos que a medida que la temperatura disminuye dentro del mismo, el aire dentro se comprime y el envase se deforma. La explicación es muy sencilla. Al tapar el envase, evitamos en intercambio de aire, y por lo tanto la presión dentro del envase es siempre la misma. Aplicando la Ecuación de Estado del gas ideal con T2 ‹T1,
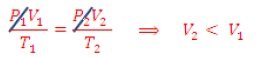
El envase se comprime. Y entonces ¿Ahora cómo calculamos cuánto es la variación de volumen?...Ya que T1=300 K, T2=273 K, V1=1.5 L, obtenemos que el volumen final (V2) es,
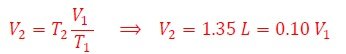
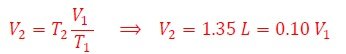
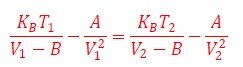
Cuya única solución posible es V2 ‹ V1. Al igual que el gas ideal, al invertir el proceso térmico se produce la expansión del gas, recuperando el envase su volumen inicial.

En el video a continuación les presento el experimento directo desde mi cocina de la “Física es Divertida”.
Comentarios finales
En esta ocasión les he mostrado como las Leyes de la Termodinámica están presentes en nuestra casa, cocina, nevera, etc. Inclusive dentro de nuestro organismo. Vimos una aplicación cotidiana de aquellas Leyes extrañas que nos enseñaron en Física de Bachillerato y Física Básica Universitaria: Ley de Boyle, Ley de Charles y Ley de Gay-Lussac.
El aire es el gas que respiramos, por el vivimos y morimos, está por todas partes a su vez, pero está sujeto es todas estas Leyes físicas. No podemos hacer lo que queramos con el aire y a veces hace trucos que nos dejan asombrados.
Vimos como el aire frío no se comprime si está en un entorno abierto, pero cambia su estado cuando lo confinamos en un envase cerrado. Es un gas real con propiedades de gas ideal. También les mostré que un gas como el aire no solo se comprime/descomprime por gradientes de presión sino también por enfriamiento/calentamiento.
Antes de despedirme, me gustaría llamar la atención de la comunidad de docentes tanto a nivel medio como universitario, para que consideren incorporar en sus actividades docentes la discusión de estos problemas cotidianos, donde las leyes y principios de la física son la base fundamental.

Lecturas sugeridas sobre física divertida y otras curiosidades de física:
1. Neil Ardley, 101 grandes experimentos. La ciencia paso a paso (Ediciones B, 1997).
2. Isabel Amato y Christian Arnould, 80 experimentos para hacer en casa. Respuestas a los curiosos (Ediciones B, Barcelona, 1992).
3. Fundación Thomas Alva Edison, Experimentos fáciles e increíbles (Martínez Roca, Barcelona, 1993).
4. Judith Hann, Guía práctica ilustrada para los amantes de la ciencia (Blume, Barcelona, 1981).
5. Antonella Meiani, El gran libro de los experimentos (San Pablo, Madrid, 2000).
6. Yakov I. Perelman, Física recreativa (Eds. Martínez Roca, Barcelona, 1971).
7. Yakov I. Perelman, Problemas y experimentos recreativos (Mir, Moscú, 1975).
8. Gaston Tissandier, Recreaciones científicas, o la física y la química sin aparatos de laboratorio y sólo por los juegos de la infancia (Alta Fulla, Barcelona, 1981).
9. Tom Tit, La ciencia divertida (José J. de Olañeta, Palma de Mallorca, 1992).
10. Alejandra Vallejo-Nágera, Ciencia mágica. Experimentos asombrosos para genios curiosos (Martínez Roca, Barcelona, 1999).
11. Janice P. Van Cleave, Física para niños y jóvenes. 101 experimentos super divertidos (Limusa, México, 1997).
Lecturas recomendadas sobre principios de la Termodinámica, leyes de los gases y propiedades del aire
12. A. M. Vasilyev, An Introduction to Statistical Physics (MIR, Moscú, 1983).
13. H. B. Callen, Thermodynamics (John Wiley & Sons, Inc., New York, 1960).
14. Charles Kittel, Thermal Physics (John Wiley & Sons, Inc., New York, 1969).
15. Kshudiram Saha, The Earth´s Atmosphere: Its Physics and Dynamics (Springer, Berlin, 2008).
16. F. Reif, Física Estadística, Berkely Physics Course-Vol. 5 (Reverté, España, 1969).
Saludos estimado @jfermin70. Impresionante explicación y didáctica con la que presenta tan extraordinario trabajo. Mis felicitaciones.
This post has been voted on by the steemstem curation team and voting trail.
There is more to SteemSTEM than just writing posts, check here for some more tips on being a community member. You can also join our discord here to get to know the rest of the community!
Excelente trabajo amigo y colega @jfermin70. Es de muy fácil lectura debido a su excelente presentación y didáctica. La Termodinámica, es una de las áreas de la Física que me encantan. Saludos.
Congratulations @jfermin70! You have completed the following achievement on Steemit and have been rewarded with new badge(s) :
Click on the badge to view your Board of Honor.
If you no longer want to receive notifications, reply to this comment with the word
STOPDo not miss the last post from @steemitboard:
SteemitBoard and the Veterans on Steemit - The First Community Badge.
Hi @jfermin70!
Your post was upvoted by utopian.io in cooperation with steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
Un artículo interesante, excelente explicación y apropiadas herramientas para socializar la información te felicito @jfermin70, nos seguimos leyendo
Como es de costumbre profesor, siempre deleitando ala comunidad con maravillosas clases de fisica :)
Excelente explicación de las propiedades de los gases estimado @jfermin, my didáctica explicación de las leyes termodinámicas aplicadas a nuestro entorno. Saludos.