Evaluación de algunas propiedades catalíticas de β-amilasas (EC 3.2.1.2) extraídas de la batata (Ipomoea batata)
Las enzimas son moléculas de naturaleza proteica que actúan como catalizadores de todas las reacciones del metabolismo, estas pueden acelerar la formación de un producto a partir de un sustrato mediante la disminución de la energía de activación. Se extrajeron enzimas β-amilasas (EC 3.2.1.2) de la batata (Ipomoea batata) mediante la homogeneización, filtración y centrifugación de una muestra de 50 g de tejido radicular (tubérculo) con el fin de determinar la actividad enzimática usando almidón como sustrato y la influencia sobre esta, de algunos parámetro cinéticos como la temperatura y tiempo de incubación y las concentraciones de enzima y de sustrato. Se usó DNSA para la cuantificación espectroscópica, coloreando la maltosa producto de la catálisis y para determinar la actividad de la enzima en función de esta. Se encontró una actividad enzimática de 0,0443 U a temperatura ambiente, y se evidenció el aumento de esta en función de la concentración de enzima y de almidón y una disminución en función del tiempo de incubación. La máxima actividad enzimática se detectó a los 70 ºC y la mínima a los 40 ºC, finalmente, se determinó que el Km para el almidón es de 0,4866 %m/v o 4,86 mg/ml.
1. INTRODUCCIÓN
Las enzimas son proteínas especializadas en la catálisis de las reacciones biológicas. Se encuentran entre las más notables de las biomoléculas conocidas debido a su extraordinaria especificidad y a su poder catalítico, que es mucho mayor que la de los catalizadores hechos por el hombre [1]. Dada su naturaleza proteica, las enzimas son afectadas en su actividad por factores físicos como la temperatura, la fuerza iónica, el pH, y químicos como las concentraciones de sustrato e inhibidores [2], siendo todos estos, factores a tomar en cuenta cuando se trabaja con estas biomoléculas. Esto se logra caracterizando a la enzima, y definiendo rangos óptimos de funcionamiento o de tolerancia a distintos parámetros bioquímicos.
Los principios generales de la cinética de las reacciones químicas son aplicables a las reacciones catalizadas por las enzimas, es así como L. Michaelis y M. Menten lograron desarrollar una ecuación modelo que se ajusta al comportamiento de las enzimas en una reacción [1]. A partir de esta ecuación se pueden delucidar parámetros experimentales catalíticos propios de la enzima, como su Km (constante de Michaelis-Menten) para un sustrato, con base en la linealización de la ecuación de la velocidad, llamada modelo lineal de Lineweaver-Burk [3]. La constante de Michaelis-Menten (Km) es una magnitud determinada experimentalmente y definida como la concentración de sustrato a la cual la velocidad de la reacción es la mitad de la velocidad máxima [1].
La batata o papa dulce (Ipomoea batata) es un tubérculo cuyo contenido de almidón, la convierte en una importante fuente comercial de carbohidratos como la glucosa [4]. En esta, las más abundantes de las enzimas amilolíticas son las α-amilasas, β-amilasas (EC 3.2.1.2 [5]) y la almidón fosforilasa, entre las cuales la más abundante son las β-amilasas, constituyendo hasta un 5% del total de proteínas solubles de la raíz tuberculosa [6]. Por su parte, esta enzima hidroliza los enlaces glucosídicos α (1-->4) en los polisacáridos para remover unidades sucesivas de maltosa [5] y posee una temperatura, pH y un Km óptimos de 53 ºC, 5.3-5.8, y 3.71 mg/ml [6,7].
Las β-amilasas tiene una actividad enzimática asociada, medida en “unidad de actividad enzimática” (U) la cual es la cantidad de enzima que cataliza la trasformación de un μ mol de sustrato por minuto a 25 ºC en condiciones óptimas de medida [8]. Dicha actividad, por lo general, se mide cuantificando la cantidad de producto generado, en este caso, la cantidad de maltosa, con lo cual resulta necesario marcar esta azúcar para su posterior cuantificación espectroscópica. Uno de los métodos más conocidos es la aplicación de DNSA (Ácido 3,5-dinitrosalicílico), el cual se basa en la oxidación simultánea de grupos funcionales del azúcar y la reducción de dicho ácido hasta ácido 3-amino-5-nitrosalicílico (mediante la aplicación de calor), el cual absorbe luz a 540 nm [9].
En el presente estudio, se describe el proceso de obtención de un extracto enzimático de β-amilasas (EC 3.2.1.2) a partir de una batata (Ipomoea batata), con la finalidad de determinar el Km y la actividad enzimática y además evaluar el efecto en esta, de la temperatura, tiempo de incubación, y concentraciones de enzima y de sustrato.
2. MATERIALES Y MÉTODOS
2.1 Curva de calibración de la maltosa
Seis soluciones en diferentes tubos fueron preparadas vertiendo volúmenes de agua del 0 a 1 ml en intervalos de 0,2, se agregó luego maltosa en cada solución de manera que se alcanzara un volumen final de 1 ml en cada muestra. Se agregaron 0,5 ml de DNSA, y se incubó por 5 min en un baño maría a 100 ºC, posteriormente se midió la absorbancia a 540 nm en el espectrofotómetro (Thermo Scientific GENESYS 10 UV-Vis).
2.2 Extracción de la enzima
De una batata (Ipomoea batata) se tomaron 50 g y se homogeneizó la solución en la licuadora con 50 ml de agua durante 2 min. Se filtró luego con una gasa, se centrifugo a 10.000 rpm por 10 min (Microcentrífuga Labnet), y finalmente se realizó una dilución 3/50 del sobrenadante obtenido. El extracto enzimático fue sumergido en hielo para su posterior uso.
2.3 Determinación de la actividad enzimática
Se prepararon dos soluciones, una usando 0,5 ml de almidón al 1 % y 0,5 de extracto enzimático, y otra usando 0,5 ml de agua y 0,5 de extracto enzimático. Ambas se incubaron a temperatura ambiente por 5 min, luego se les agregaron 0,5 ml de DNSA y se incubaron por 5 min en un baño maría a 100 ºC. Finalmente se agregaron 3 ml de agua y se centrifugó a 8.000 rpm por 2 min. La absorbancia del sobrenadante se midió a 540 nm en el espectrofotómetro.
2.4 Propiedades catalíticas
2.4.1 Efecto de la concentración de la enzima
En seis soluciones que contenían solo 0,5 ml de almidón al 1 % se vertieron volúmenes de 0 a 0,5 ml del extracto enzimático en intervalos de 0,1 ml. Se completó cada solución con agua hasta alcanzar un volumen final de 1 ml y se dejaron incubar a temperatura ambiente durante 5 min. Luego se agregaron 0,5 ml de DNSA incubando por 5 min en un baño maría a 100 ºC. Posteriormente se adicionaron 3 ml de agua y se centrifugó a 8.000 rpm por 2 min para luego medir la absorbancia del sobrenadante a 540 nm.
2.4.2 Efecto de la concentración de sustrato
Se vertieron volúmenes de 0 a 0,5 ml de almidón al 1 % en intervalos de 0,1 ml para preparar seis soluciones distintas. Se agregaron 0,5 ml del extracto enzimático y se usó agua para completar hasta 1 ml de solución en cada caso. Dichas soluciones se incubaron a temperatura ambiente por 5 min, se les agregaron 0,5 ml de DNSA, y se incubaron de nuevo por 5 min, ahora en un baño maría a 100 ºC. Para terminar, se agregaron 3 ml de agua y se centrifugo a 8.000 rpm por 2 min, midiendo la absorbancia del sobrenadante a 540 nm. Usando la linealización de Lineweaver-Burk, se usaron los datos obtenidos de este procedimiento para el cálculo del Km de la enzima.
2.4.3 Efecto del tiempo de incubación
Se agregaron volúmenes de 0,2 ml de agua, 0,3 ml de almidón al 1 % y 0,5 ml del extracto enzimático para preparar 4 soluciones de igual composición. Cada solución se incubó a temperatura ambiente por un tiempo diferente, siendo estos 1, 3, 5 y 10 min, después de los cuales se agregaron 0,5 ml de DNSA, y se incubaron por 5 min en un baño maría a 100 ºC. Se agregaron 3 ml de agua y se centrifugo a 8.000 rpm por 2 min para medir luego la absorbancia del sobrenadante a 540 nm.
2.4.4 Efecto de la temperatura de incubación
Se mantuvieron cuatro soluciones de extracto enzimático y sustrato (0,2 ml de agua, más 0,3 ml de almidón al 1 %) separadas a temperaturas de 4, 25, 40 y 70 °C durante 15 min, sin mezclar. Se agregó entonces la solución enzimática en la solución con sustrato, y se incubó por 5 min en las temperaturas correspondientes. Finalmente se agregaron 0,5 ml de DNSA, se incubó por 5 min en un baño maría a 100 ºC, y se agregaron 3 ml de agua para centrifugar a 8.000 rpm por 2 min y medir la absorbancia del sobrenadante a 540 nm.
3. RESULTADOS
3.1 Curva de calibración de la maltosa
Con base en las absorbancias medidas se obtuvo la curva de calibración para la maltosa, y con esta, se consiguió calcular el valor del coeficiente de determinación R2 y el valor de la constante que relaciona la absorbancia de la muestra con su concentración, en la ecuación de Lambert-Beer (Fig.1).
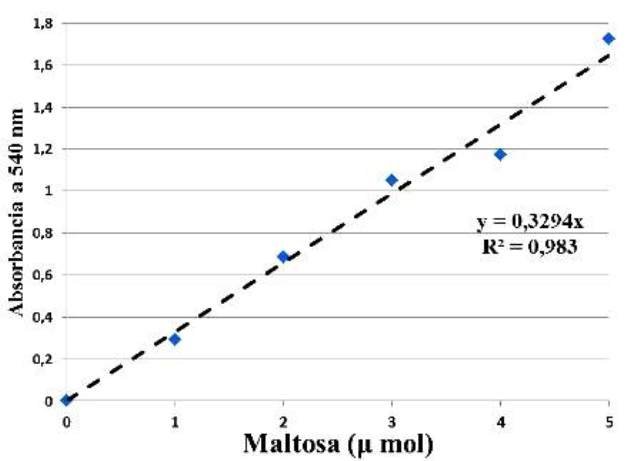
Figura 1. Curva de calibración de la maltosa en el espectrofotómetro, ecuación de Lambert-Beer y coeficiente de determinación (R2).
3.2 Actividad enzimática
Las absorbancias medidas en presencia y ausencia de almidón permitieron conocer la actividad enzimática de las β-amilasas (EC 3.2.1.2). El valor calculado fue de 0,0443769 U.
3.3 Propiedades catalíticas
3.3.1 Efecto de la concentración de la enzima sobre la actividad enzimática
3.3.1 Efecto de la concentración de la enzima sobre la actividad enzimática
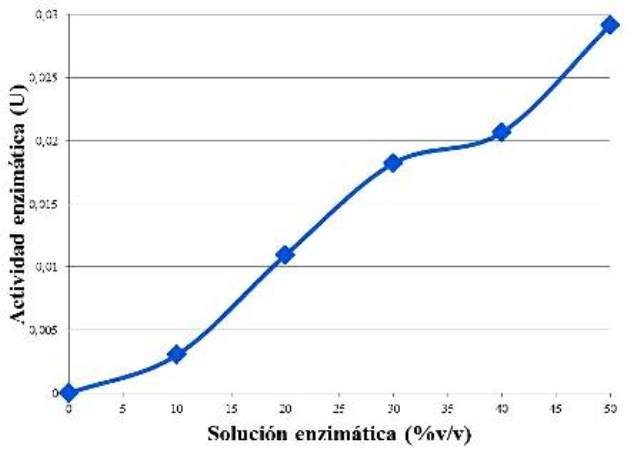
Figura 2. Curva del comportamiento de la actividad enzimática en función de la concentración de enzima.
3.3.2 Efecto de la concentración de sustrato sobre la actividad enzimática
Manteniendo la concentración de enzima constante, y aumentando la concentración de almidón (sustrato) se observó un comportamiento sigmoidal a medida de la actividad enzimática fue aumentando en función del aumento de la concentración del sustrato (Fig. 3).
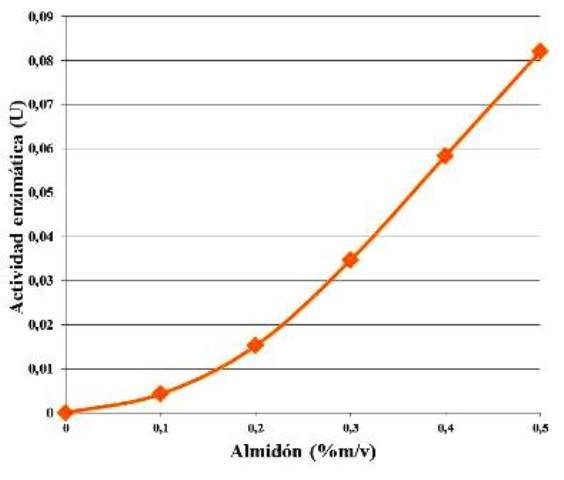
Figura 3. Comportamiento de la actividad enzimática en función de la concentración de sustrato.
3.3.3 Efecto del tiempo de incubación sobre la actividad enzimática
Siendo las concentraciones de enzima y de sustrato las mismas, se observó una disminución de la actividad enzimática a medida que aumentó el tiempo de incubación (Fig. 4).
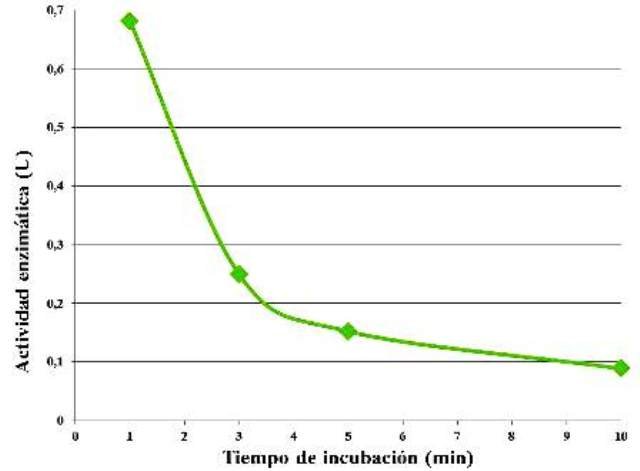
Figura 4. Actividad enzimática en función del tiempo de incubación.
3.3.4 Efecto de la temperatura sobre la sobre la actividad enzimática
Manteniendo fijas las concentraciones de enzima y de sustrato, no se evidenció una tendencia en el comportamiento de la actividad enzimática respecto al aumento de la temperatura de incubación (Fig. 5). La mayor actividad enzimática se detectó a los 70 ºC y la menor a los 40 ºC.
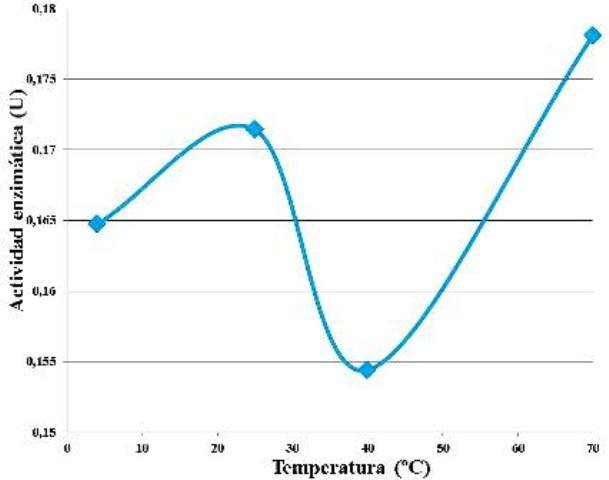
Figura 5. Actividad enzimática en función de la temperatura de incubación de la enzima y el sustrato.
3.4 Constante de Michaelis-Menten (Km) para el almidón
Empleando los datos obtenidos de la actividad enzimática en función de la concentración de sustrato, se evaluó el ajuste lineal de los datos, al modelo de Michaelis-Menten linealizado. Se reportan los valores del coeficiente de determinación (R2) y la ecuación de Lambert-Beer (Fig. 6), con la cual se determinó que es Km de la enzima para el almidón es de 0,4866 % m/v o 4,86 mg/ml.
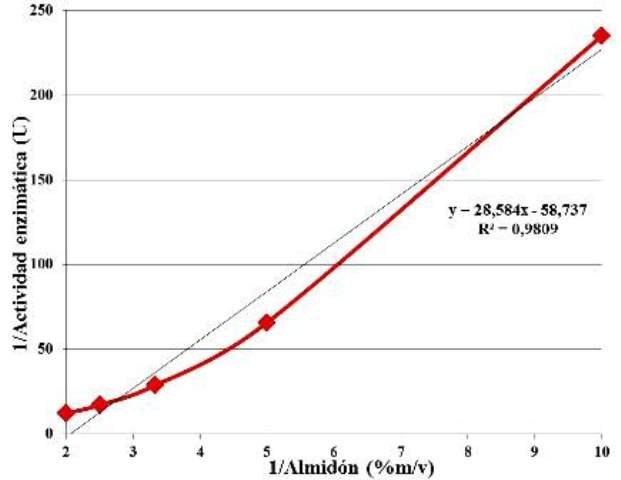
Figura 6: Ajuste lineal de los datos de la actividad enzimática en función de la concentración de sustrato, según del modelo de Lineweaver-Burk, coeficiente de determinación R2 y ecuación de Lambert-Beer.
4. DISCUSIÓN
4.1 Actividad enzimática y Km
En otros estudios ha sido reportado que el Km, definido como la concentración de sustrato a la cual la velocidad de la reacción es la mitad de la velocidad máxima [1], para las β-amilasas (EC 3.2.1.2) extraídas de Ipomoea batata es de 3,71 mg/ml [4], siendo este un valor menor que el valor obtenido durante la experimentación. Esto se puede deber a que la batata usada en otros estudios contenía menos cantidad de la enzima, debido al envejecimiento o a la falta de nutrientes, ya que se sabe que con el tiempo, el contenido de enzimas activas va disminuyendo una vez que la planta deja de nutrirse [7], es decir, una vez que el tubérculo ha sido cosechado. En todo caso, las enzimas aisladas de la batata usada, poseían menos afinidad por el almidón que las de otros estudios, debido quizás a que el ambiente en donde evolucionó la variedad de batata (más que todo mediante selección artificial accidental), es un ambiente rico en nutrientes, con lo cual la planta puede darse el lujo de almacenar mucho almidón, pues no se necesita en el resto del organismo.
Por su parte, la actividad enzimática es medida en “unidad de actividad enzimática” (U) la cual es la cantidad de enzima que cataliza la trasformación de un μ mol de sustrato por minuto a 25 ºC en condiciones optimas de medida [8], y si bien no se encontró estudios referentes a su actividad enzimática en un periodo tan corto de tiempo el valor obtenido, es un valor coherente con respecto a la cantidad de almidón, y enzima y el tiempo de incubación.
4.2 Efecto de la concentración de enzima sobre la actividad enzimática
Se observó una tendencia de aumento de la actividad enzimática proporcional al aumento la concentración de enzima (Fig. 2). Lo que ocurre es que al aumentar la concentración de enzimas, entonces habrá más de estas disponibles para catalizar más moléculas de sustrato en un intervalo de tiempo definido. Es por esto, que al incubar por 5 min, la misma cantidad de almidón, pero con diferente cantidad de enzima, se observó un aumento, porque había más enzima en algunas muestras, lo cual aceleró el proceso de hidrólisis del almidón, generando más maltosa, y por consiguiente más actividad enzimática. Si se hubiese prolongado el aumento de la concentración de enzima, en algún momento esta iba a caer en un estado estacionario, de velocidad constante, pues el sustrato iba a pasar a ser el facto limitante, haciendo que desde cierto punto, sea irrelevante la cantidad de enzima disponible.
4.3 Efecto de la concentración de sustrato sobre la actividad enzimática
La actividad enzimática fue en aumento, en función del aumento de la concentración de sustrato (Fig. 3). Esto se debe a que, mientras haya suficiente cantidad de enzimas, entonces al aumentar la cantidad de sustrato, aumentará la cantidad de complejos enzima-sustrato (ES) y se degradará el almidón más rápido en aquellas muestras que tengan mayor cantidad de éste. Sucede que al haber más moléculas de sustrato, aumenta la probabilidad (en términos espaciales) de que las moléculas de almidón se encuentren con el sitio activo de la enzima, haciendo más rápida la catálisis, y generando más maltosa en el mismo periodo de tiempo, razón que se traduce en el aumento de la actividad enzimática.
En algún punto también se espera que la actividad enzimática deje de aumentar, y se haga constante e independiente de la cantidad de sustrato, pues la enzima para a ser el factor limitante de la formación de complejo ES y por tanto de la velocidad del proceso.
4.4 Efecto del tiempo de incubación sobre la actividad enzimática.
A medida que fue aumentando el tiempo de incubación, la actividad enzimática fue disminuyendo (Fig. 4). Esto se explica en función de la concentración de sustrato, que si bien era fija, al dejar actuar la enzima por más tiempo disminuye la actividad de la misma pues ya quedan en el medio menos moléculas de almidón que catalizar. En algún punto, esta actividad se haría nula, pues ya se han acabado las moléculas de sustrato por completo. Además, inicialmente, las concentraciones de enzima son evidentemente mayores que las de sustrato, con lo cual se espera que se consumiera este rápidamente.
4.5 Efecto de la temperatura de incubación sobre la actividad enzimática
No se observó una tendencia definida de la actividad enzimática respecto al aumento de la temperatura (Fig. 5). Sin embargo, a 40 ºC se observó un mínimo y a 70 ºC un máximo. Estos sucesos no concuerdan con otros estudios, en los cuales se reporta que la temperatura óptima de las β-amilasas (EC 3.2.1.2) se encuentra entre los 50 y los 53 ºC, desnaturalizándose a los 60 ºC, y pH óptimo entre 5,3 y 5,8 [4,7]. Con base en estos datos, era de esperarse que la mayor actividad se encontrase a 40 ºC, ya que esta es la temperatura más cercana a la temperatura óptima, y que a 70 ºC, la enzima estuviese ya desnaturalizada.
Pudo ocurrir que durante la experimentación, la enzima ya estuviese oxidada, como producto de su interacción con el ambiente después de ser extraída, sin embargo, también puede haber ocurrido que el medio en el que se estaba trabajando la enzima, tenía un pH diferente del pH óptimo de la enzima, lo cual pudo haber modificado la configuración de las cargas eléctricas de los grupos aminoacídicos de la proteína, confiriéndole alguna especie de nueva resistencia altas temperaturas, y una gran inestabilidad cerca de los 40 ºC. En todo caso, siempre existe la posibilidad de que se hayan producido errores de metodología o medición durante la realización del protocolo.
5. CONCLUSIONES
• La actividad de las β-amilasas (EC 3.2.1.2) extraídas de la Ipomoea batata empleada es de 0,0443 U, y su Km para el almidón de 4,86 mg/ml.
• La variedad de Ipomoea batata empleada puede haber sido una variedad adaptada a ambientes ricos en nutrientes (suelos).
• La actividad enzimática de las β-amilasas usadas aumenta proporcionalmente con la cantidad de sustrato, y de enzima (en el rango de estos evaluado).
• La actividad enzimática de las β-amilasas usadas disminuye proporcionalmente con el aumento del tiempo de incubación.
• La máxima actividad reportada por las β-amilasas extraídas de la Ipomoea batata empleada fue a 70 ºC, y la mínima a 40 ºC.
• La muestra de β-amilasas extraídas pudo haberse oxidado, o visto afectada por algún parámetro externo.
6. REFERENCIAS BIBLIOGRÁFICAS
[1] Lehninger A. Bioquímica: las bases moleculares de la estructura y función celular. 2da edición. Barcelona: Ediciones Omega, S.A.; 1978. p 1117.
[2] Díaz J, Hicks J. Bioquímica. 2da edición. México: Nueva Editorial Interamericana, S.A.; 1995. p 749.
[3] Voet D, Voet J. Bioquímica. 3ra edición. Madrid: Editorial Médica Panamericana S.A.; 2006. p 1776.
[4] Hagenimana V, Vézina L, Simard R. Sweetpotato α and β-amylases: Characterization and kinetic studies with endogenous inhibitors. J Food Science. 1994: 59 (2): 373-377.
[5] Brenda: The comprehensive enzyme information system [internet]. Alemania: Technische Universitat Braunschweig; [consultado en abril del 2015]. Disponible en: http://www.brenda-enzymes.org/enzyme.php?ecno=3.2.1.2
[6] Dziedzoave N, Graffham A, Westby A,Otoo J, Komlaga G. Influence of variety and growth environment on β-amylase activity of flour from sweet potato (Ipomoea batatas). Food Control Elsevier. 2010: 21: 162-165.
[7] Chang C, Liou H, Tang H, Sung H. Activation, purification and properties of beta-amylase from sweet potatoes (Ipomoea batatas). Bio App Biochem. 1996: 24: 13–18.
[8] Teijón J, Garrido A. Fundamentos de bioquímica estructural. 2da edición. Madrid: Editorial Tébar, S.L.; 2006. p 444.
[9] Texeira R, Silva A, Ferreira-Leitão V, et al. Amino acids interference on the quantification of reducing sugars by the 3,5-dinitrosalicylic acid assay mislead carbohydrate activity measurements. Carbo Res. 2012: 366: 33–37.
¡Felicitaciones!
Estas participando para optar a la mención especial, que se efectuará el 08 de Julio del 2018 a las 8:00 pm (hora de Venezuela); donde el autor del artículo seleccionado recibirá la cantidad de 1 SBD transferidos a su cuenta.
Contáctanos en Discord: https://discord.gg/hkCjFeb
Apoya al trail de entropía y así podrás ganar recompensas de curación de forma automática, entra aquí para más información sobre nuestro TRAIL.
Puedes consultar el reporte diario de curación visitando @entropia
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Excelente post. Gran metodología !!!
Muchas gracias
Excelente trabajo @khrisaeroth, un gran aporte a la ciencia.
Que bueno que compartas de esos conocimientos con la comunidad
Excelente @khrisaeroth ...un post bastante detallado, propio de las investigaciones experimentales. Una entrega que vale la pena leer.
Creo que es una fortuna tener a disposición diversos equipos, como el mencionado espectrofotómetro (Thermo Scientific GENESYS 10 UV-Vis). Lo más parecido que recuerdo haber manejado fue el Spectronic 21 - adquirido por mis mentores en la década de los 80 o 90, y luego no se adquirieron nuevos equipos, por diversas razones institucionales y del país.
Infiero que en próximas entregas podremos ver estudios similares y comparativos realizados con base en otros tubérculos. Felicitaciones por tu post... sigue adelante.
Muy buena tu publicación, deberías poner un poco mas detalle en las gráficas se ven un poco pixeladas, pero el contenido muy bueno.