Conozcamos las características y propiedades del Zinc, Cadmio y el Mercurio
Saludos queridos amigos integrantes de #Steemit. Antes de comenzar mi nueva publicación quiero agradecer el apoyo de la comunidad #Stem-espanol para el contenido científico de alta calidad y que ayudan al crecimiento de las comunidades de habla hispana. He observado en las ultimas semanas como ha aumentado el numero de personas que quieren pertenecer a esta ilustre comunidad para seguir creciendo dentro de esta red.
Ahora si, con ganas de seguir haciendo ciencia, especialmente química y física, les traigo un nuevo post con experimentos de laboratorios que realice para esta red para mostrarles las propiedades de los metales Zinc, Cadmio y Mercurio. Espero les guste.
Introducción
El grupo doce de la tabla periódica está formado por los elementos Zinc, Cadmio y Mercurio. Estos elementos no son considerados metales de transición aun cuando están en el bloque de ellos, porque en su última capa de electrones de valencia tienen un nivel d n-1 seguido de un orbital ns. Estos son capaces de de formar complejos con grupos nitrogenados y haluros. Pero no forman complejos con ligandos aceptores de electrones pi. Generalmente trabajan con un estado de oxidación +2 y +1.
El zinc encabeza el grupo y es un metal de color blanco azulado que en presencia del oxígeno ambiental arde en llamas de tonos verdes azulados. En el vacío no es capaz de oxidarse pero la humedad del ambiente provoca que en la superficie se cree una capa de óxido de carbonato que cubre el metal y lo cuida de la corrosión. Seguido de él, está el cadmio que de forma similar es blanco azulado, es un metal muy dúctil y maleable. Contrario a estos es el mercurio que es el único metal de la tabla periódica que es líquido a temperatura ambiente, de color gris plateado inodoro que no conduce el calor como los demás metales de transición pero si un buen conductor eléctrico. Este metal posee la capacidad de alearse con el oro y la plata para formar amalgamas insolubles en agua ya que solo es soluble en ácidos.
A partir de métodos de laboratorios les demostraré las características y propiedades que poseen estos 3 elementos del grupo 12 de la tabla periódica.

Figura 1. Elementos- Fuente: @VianniS
Metodología Experimental y Resultados Obtenidos
1 Reacción del Zn y Hg en presencia de Ácidos Concentrados.
Procedimiento
En una gradilla se colocaron 3 tubos de ensayos a los cuales se añadió una porción de ácido clorhídrico, sulfúrico y nítrico; seguidamente se le adicionó zinc en polvo a cada tubo de ensayo observando la reacción resultante esto se realizo bajo campana. Dicha experiencia se repitió pero cambiando el zinc por mercurio.
Zn + HCl
Al agregar el zinc al ácido clorhídrico la solución se tornó grisácea, observándose un burbujeo que provenía del zinc, este continuo reaccionando hasta eliminar por completo el color gris tornándose incolora la solución (Ver Figura 2). Según la literatura la reacción siguiente es la que ocurre [1]:

Zn + H2SO4
Al reaccionar el Zn con H2SO4 dicha reacción fue lenta observándose la formación de burbujas, un desprendimiento de gas incoloro y la solución se tornó grisácea, el zinc no se disolvió por completo observando un sólido en el fondo del tubo (Ver Figura 2). La reacción desarrollada es la siguiente [2]:
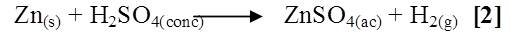
Zn + HNO3
Al mezclar Zn con HNO3, se notó una reacción violenta, más apreciable que las anteriores con desprendimiento de un gas color pardo, tornándose la solución amarilla, se presume que la reacción ocurrida fue la siguiente [3]:
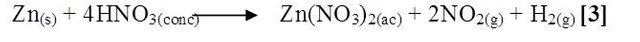
Los metales situados antes del hidrógeno en la serie de potenciales desplazan al hidrógeno de los ácidos. Los alcalinos, el aluminio y el zinc desplazan fácilmente al hidrógeno de los ácidos, donde se halla combinado como ion hidrógeno positivo, liberándose como hidrógeno molecular. En el caso de la reacción de un ácido con un metal, más reductor que el hidrógeno en la serie electroquímica, es llama reacción oxido-reducción. El Zinc se disuelve en ácidos clorhídrico y sulfúrico desprendiendo hidrógeno, con el agua sólo reaccionan superficialmente, al formarse una capa de hidróxido. Un análisis basado en los potenciales estándar de reducción a temperatura ambiente, certifica la reactividad de ácidos minerales sobre el Zinc, ya que este metal posee un potencial bastante bajo igual a -0,76V, siendo idóneo a la acción de ácidos e inclusive al agua. Según los valores de entalpía y energía de libre de Gibbs, los valores de ambas magnitudes para cada reacción, son negativos lo que indica el carácter espontáneo y exotérmico de cada una de ellas. El ácido nítrico es el oxidante más potente, de tal manera que es el que reacciona de forma más espontanea frente al Zinc.

Figura 2. Efectos de los Ácidos Concentrados sobre el Zinc-Fuente: @VianniS
En el caso del mercurio con ácido clorhídrico y sulfúrico no se observó ningún cambio debido a que el potencial de oxidación del mercurio es mayor permaneciendo insoluble en el ácido. A diferencia del ácido nítrico que si reacciono, apreciándose un desprendimiento de gas pardo, tornándose de color amarilla la solución (Figura 3). Se presume que las posibles reacciones involucradas son las siguientes [4],[5],[6]:
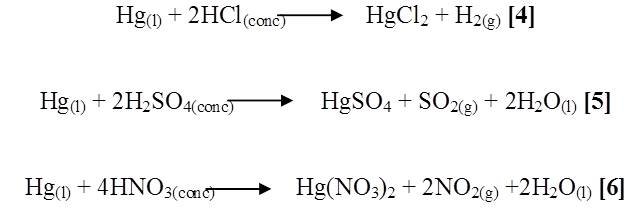
Se observó que para las reacciones [4] y [5] tienen valores positivos de energía libre de Gibbs y de entalpia que indican que efectivamente estas dos reacciones no son espontáneas y por lo tanto favorece a la formación de reactivos.
En cambio en la reacción [6] tiene valor negativo de la energía libre de Gibbs y la reacción ocurrida fue espontanea. Se constato que la disminución de su actividad reductora se ilustra por la posición de estos metales en la serie electroquímica, es decir el zinc y el cadmio están por encima del hidrógeno mientras que el mercurio está por debajo del mismo. El mercurio posee un valor de +0,85V por lo tanto no actúa sobre hidrácidos desplazando hidrógeno, es por este motivo que la reacción con el ácido clorhídrico no procedió. Sin embargo su reacción con ácido nítrico es favorecida por el alto potencial de reducción del ion nitrato igual a +0,96V, lo que indica que el ion nitrato actúa como agente oxidante sobre este metal.
De acuerdo a las observaciones, y en apoyo con lo expuesto en la literatura y los valores de las magnitudes termodinámicas obtenidas, puede afirmarse que la actividad reductora de los metales del grupo 12, disminuye a medida que aumenta el número atómico del metal, más difícil es su oxidación, mostrándose éste como un débil agente reductor.

Figura 3. Efectos de los Ácidos sobre el Mercurio- Fuente: @VianniS
2 Reacción del Zinc con Hidróxido de Sodio.
Procedimiento
En un tubo de ensayo se añadió una porción de hidróxido de sodio (NaOH), seguidamente se le agrego zinc en polvo a dicha solución, observándose así la reacción ocurrida en el tubo de ensayo.
Al agregar el zinc en polvo al hidróxido de sodio, la solución se tornó grisácea, quedando un precipitado gris en el fondo del tubo al dejar reposar. La reacción involucrada es la siguiente [7]:

Los valores termodinámicos deducen que la reacción es espontánea, exotérmica y se favorece la formación de los productos. El Zinc metálico a diferencia del cadmio y el mercurio, se disuelve también en soluciones alcalinas (carácter anfótero) debido a su tendencia a formar iones cincato.

Figura 4. Reacción del Zinc con Hidróxido de Sodio-Fuente:@Viannis
3 Poder Reductor de la Amalgama de Sodio (Na) y Mercurio (Hg).
Procedimiento
En un mortero se preparó la amalgama, adicionando un pequeño trozo de sodio (Na), seguidamente se le agrego el mercurio (Hg), se trituró el mercurio con el sodio hasta la formación de un sólido gris oscuro. Finalmente a esta amalgama se le añadió una solución de permanganato de potasio (KMnO4) acidificado con ácido sulfúrico diluido (H2SO4). Observando así lo que sucedía.
Al triturar el sodio con el mercurio se observó una llama amarilla formándose así la amalgama, al agregarle el permanganato de potasio (KMnO4) acidificado con H2SO4, se produjo un burbujeo notándose un cambio de color de morado a marrón quedando el mercurio liquido en el fondo (Figura 5). Reacción para la producción de la amalgama es la siguiente [8]:
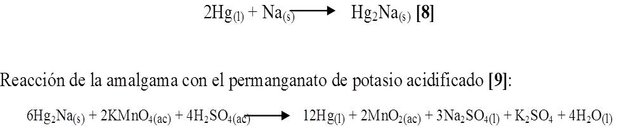
Se observó la variación de color que se indicó anteriormente, y mientras la solución reaccionaba con la amalgama se desprendía mercurio líquido, entonces se demuestra el poder reductor de la amalgama Hg2Na. Esto puede explicarse ya que el sodio de la amalgama reduce al [MnO4]- a MnO2 que es un sólido de color marrón, es decir el Mn+7 pasa a Mn+4 mientras que por su parte la amalgama se descompone quedando el Hg solo en el fondo que es la sustancia plateada que se observa debajo y el sodio se oxida de Na0 a Na+1.

Figura 5. Poder Reductor de la Amalgama-Fuente:@Viannis
4 Efecto del Hidróxido de Sodio Sobre las Sales de Zinc, Cadmio y Mercurio.
Procedimiento
Se trataron algunas sales solubles de estos metales (CdCl2, HgCl2, y ZnCO3) con hidróxido de sodio (NaOH) empleando el siguiente procedimiento. En una gradilla con 3 tubos de ensayo, se agregó una porción de hidróxido de sodio a cada tubo. Luego se adicionó una sal soluble de cada metal respectivamente, observando así el comportamiento de cada una en medio alcalino.
ZnCO3 + NaOH
Al añadir el carbonato de zinc al hidróxido de sodio se observó que la solución se tornó blanca quedando así un precipitado blanco en el fondo del tubo, se presume que la ecuación siguiente es la desarrollada.
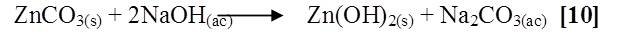
CdCl2 + NaOH
Al agregar el cloruro de cadmio al hidróxido de sodio la solución se coloreó blanca, al dejar reposar el tubo se observó un precipitado blanco, la posible reacción es la siguiente [11]:
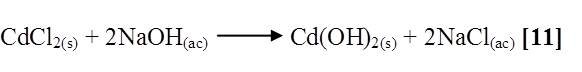
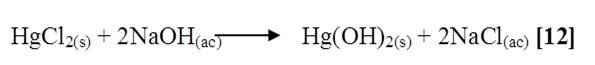
HgCl2 + NaOH
Al mezclar cloruro de mercurio con hidróxido de sodio se notó que la solución se tornó grisácea, quedando un precipitado gris oscuro en el fondo del tubo. La reacción es la siguiente [12]:
Comúnmente los hidróxidos de Zinc y Cadmio se obtienen por la reacción de las sales solubles de estos metales con álcalis siendo estos insolubles. Los hidróxidos de mercurio, también se obtienen por intercambio de sal con álcalis, pero son inestables y se descomponen al formarse originando el óxido y agua. Al observar estas reacciones vale destacar la diferencia entre los álcalis formados, ya que el hidróxido de cadmio es más básico que el hidróxido de zinc el cual tiene carácter anfótero.

Figura 6. Efecto del NaOH sobre las sales de los metales-Fuente:@Viannis
5 Calcinación de los óxidos de los metales
Procedimiento
Se calentaron con un mechero los óxidos de los metales Zinc y Cadmio, empleando crisoles con tapa colocados en una rendija. Después de calentarlos se observó cualquier cambio de color de la especie formada a raíz del calor suministrado y así proceder a la anotación las observaciones pertinentes.
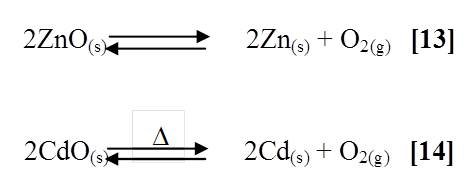
Cuando se calcinaron los óxidos de los metales (Zinc y Cadmio), se pudo observar el cambio de color característico de cada uno de ellos. El óxido de zinc de ser un sólido blanco pasó a un color amarillento y al dejarlo enfriar volvió a su color inicial [13], en el caso de óxido de cadmio de color blanco a se convirtió en una masa blanca ya que no alcanzo la temperatura adecuada para que cristalizara [14], las reacciones involucradas son las siguientes:
6 Acción del Mercurio sobre la lámina de Cobre.
Procedimiento
Sobre un vidrio reloj se colocó una placa de cobre previamente lijada y limpia, a esta se le agregó unas gotas de cloruro de mercurio. Luego de unos minutos se lavó la placa y se registraron los cambios ocurridos.
Al agregarle el cloruro de mercurio a una lámina de Cobre previamente lijada, se observó la formación de un compuesto cristalino azul brillante y un precipitado negro sobre la lámina. Al quitar la capa azul se notó la presencia de un color plateado brillante en toda la superficie de la lámina a manera de cubierta [15]. La reacción que ocurrió fue:
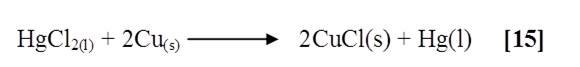
El mercurio actúa como un oxidante sobre el Cobre, reduciéndose éste a su estado elemental. Teóricamente, esto es demostrado por el alto potencial de reducción del mercurio a temperatura ambiente igual a +0,85 en comparación con el del cobre igual a +0,34; y efectivamente de acuerdo a la reacción anterior la capa que se retiró, pertenecía al cloruro de cobre formado, seguidamente al raspar la lámina y se observó el color bronce metálico característico del cobre, lo que indica que lo que hace el mercurio es recubrir el Cobre y protegerlo de la oxidación por el aire, la humedad y otros agentes.
7 Acción del Cloruro de Estaño (SnCl2) sobre las sales solubles de mercurio.
Procedimiento
En una gradilla se colocaron tres tubos de ensayo, cada uno conteniendo de una sal de mercurio en disolución acuosa, siendo estas: Nitrato de mercurio (Hg(NO3)2), bromuro de mercurio (HgBr2) y cloruro de mercurio (Hg2Cl2). A los cuales se les experimentó su acción con cloruro de estaño (SnCl2).
Al agregar cloruro de estaño a las sales solubles de mercurio (HgCl2 y HgBr2), se observó un precipitado blanco para ambos casos, al tratar el (Hg(NO3)2) se notó un precipitado color gris. Según la literatura la reacción involucrada es la siguiente [16]:
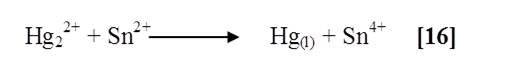
Las sales mercúricas poseen propiedades oxidantes; la reducción de mercurio (Hg+2) puede desarrollarse hasta sales mercuriosas o mercurio elemental.
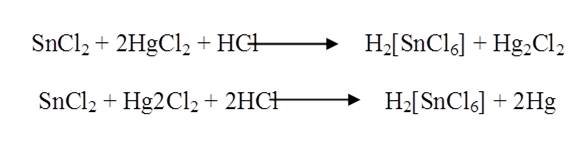
8 Preparación del Tetra tiocianatocobaltato (II) de mercurio. Hg[Co(SCN) 4]
Procedimiento
Se prepararon las soluciones a utilizar para la formación del complejo, la primera solución se preparó utilizando 7 gr de sulfato de cobalto heptahidratado y 7,5 gr de tiocianato de amonio en 15 mL de agua destilada, en la segunda se utilizó 6,5 gr de cloruro de mercurio en 75 mL de agua destilada. Luego de su preparación se filtró. Se calentaron ambas soluciones hasta ebullición para ser mezcladas.
Dichas soluciones se pueden observar en la (Figura 7), estas fueron mezcladas al ebullir a 90ºC. Se observó la aparición de un precipitado azul, que es el complejo, se calentó unos minutos más y luego se filtró la solución, el peso del precipitado fue de 0,8 gr. La reacción es la siguiente [17]:


Figura 7. Preparación de las soluciones y complejo-Fuente:@Viannis
Disposiciones finales.
• La configuración d10s2 de esta familia no da lugar a reacciones químicas redox de tipo extenso. La tendencia general es perder electrones s para formar cationes 2+ estables; en realidad esto permite describir todas las reacciones químicas redox del zinc.
• El zinc es el anfótero de este grupo ya que reacciona con los ácidos y con las bases, a diferencia de los otros elementos de este grupo.
• la actividad reductora de los metales del grupo 12, disminuye a medida que aumenta el número atómico del metal, más difícil es su oxidación, mostrándose éste como un débil agente reductor.
• El zinc y el cadmio son relativamente activos y muy parecidos entre si, y el mercurio es un metal noble, estos metales tienen gran tendencia a formar iones complejos y compuesto covalentes, sus iones sencillos son divalentes.
• El mercurio disuelve al sodio formando amalgamas de sodio con un gran poder reductor; también forma aleaciones con otros metales para importantes usos industriales.
• La calcinación de los óxidos de zinc, cadmio y mercurio genera el metal en su estado elemental y oxigeno diatomico. Este proceso es altamente endotérmico por lo que es favorecido a altas temperaturas.
• El mercurio actúa en ocasiones como agente oxidantes sobre otros metales, con potencial de reducción bajo formando una amalgama que los recubre y protege lo agentes externos.
Espero que les haya nutrido de conocimiento científico. Y si quieren seguir leyendo contenido de calidad e interactuar con científicos, médicos e ingenieros de diferentes áreas les extiendo la invitación a nuestro canal de Discord de la comunidad científica #Stem-espanol
Referencias Bibliográficas.
- F. A. Cotton, G. Wilkinson, C. A. Murillo, M. Bochmann, Advanced Inorganic Chemistry, 6th Ed. John Wiley & Sons, 1999. USA.
- Sienko, M.,Plane,R., Química. Séptima Edición. Editorial Aguilar. España. 1970.
- Semishin, V., Prácticas de Química General Inorgánica. Editorial Mir. Moscú. 1967.
- Chang, R. 2007. Química General. 9na edición. Editorial McGraw Hill. Pág. 137-140.
- Cotton, A., Wilkinson, A., Química Inorgánica Avanzada. Editorial Limusa. México 1976.
- Shriver & Atkins. Química Inorgánica, cuarta edición. Editorial McGraw Hill. México 2006.
¡Felicitaciones!
Apoya al trail de entropía y así podrás ganar recompensas de curación de forma automática, entra aquí para más información sobre nuestro TRAIL.
Puedes consultar el reporte diario de curación visitando @entropia
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Gracias por el apoyo contaste. :D
Congratulations @viannis! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
Click on the badge to view your Board of Honor.
If you no longer want to receive notifications, reply to this comment with the word
STOPDo not miss the last post from @steemitboard:
Thanks to the support.
@orinoco
Hola. Gracias por el apoyo. los visitare
Excelente demostración y análisis de las reacciones que involucran a este grupo de metales @viannis, cuando haces referencia a que en la reacción del Zn con HNO3 se observó desprendimiento de un gas color pardo, ciertamente se produce por la formación de dioxido de nitrógeno, en soluciones diluidas de ácido tiende a formarse NO, y el gas producido es incoloro
Hola colega. Ciertamente en soluciones diluidas se forma el oxido de nitrógeno, pero en este caso la solución era concentrada por lo que el gas producido en Dióxido de nitrógeno y el gas es de color pardo.
This post has been voted on by the steemstem curation team and voting trail.
There is more to SteemSTEM than just writing posts, check here for some more tips on being a community member. You can also join our discord here to get to know the rest of the community!
Thanks for the support.
Increíble este post me recordó mi tiempo en la universidad gracias por traernos este maravilloso articulo.
Posted using Partiko Android
Saludos estimado. Gracias por leer mi articulo.
Hi @viannis!
Your post was upvoted by utopian.io in cooperation with steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
Helllo. Thanks to the support. :D
Felicitaciones @viannis, excelente trabajo el que nos presentas sobre las propiedades del Zinc, Cadmio y el Mercurio. Disfruté su lectura. Te invito a ver mi post sobre la Energía. Saludos.
Excelente post @viviannis, me gustan muchos los experimentos que presentaste, felicidades y saludos!