Determinación Del Ácido Acetilsalicílico En Productos Farmacéuticos Por Espectrometría Infrarroja Con Transformada De Fourier
Feliz día a todos los lectores de esta red social. #Steemit. Especialmente a nuestra comunidad de #Stem-espanol.
Como todos los que me leen frecuentemente saben que soy Químico y es la rama de la ciencia que me apasiona en todos sus aspectos. Ademas siento una entera satisfacción al mostrarles a otros profesionales de diferentes áreas mis trabajos y que lo entiendan. Por ello les mostrare en este post como la espectroscopia infrarroja es una técnica útil para determinar concentraciones de sustancias presentes en muestras problemas.
Introducción
El ácido acetilsalicílico o aspirina como es conocido en Venezuela, es un ácido orgánico que fue descubierto y producido por vez primera en 1853 por el químico francés Charles Frédéric Gerhardt; Pero no fue en esta fecha que se conocieron sus propiedades analgésicas sino 40 años más tardes en 1897 cuando el científico farmacéutico alemán Felix Hoffmann, quien laboraba en los laboratorios Bayer estudio sus propiedades con el fin de encontrar alivio a los dolores que presentaba su padre por un reumatismo crónico y que trató con el ácido salicílico. Este mostró algunos efectos secundarios y accidentalmente fue sintetizado el ácido acetilsalicílico con gran pureza. El ácido acetilsalicílico o AAS (C9H8O 4) es un medicamento perteneciente a la familia de los salicilatos que tienen propiedades antiinflamatorias, antipiréticos, antiagregantes y analgésicas. Este fármaco usualmente es administrado vía oral y se absorbe de manera muy rápida por el tubo gastrointestinal. Este medicamento tiene una serie de usos extensa desde el tratamiento de las migrañas y cefaleas hasta las inflamaciones de la artritis.
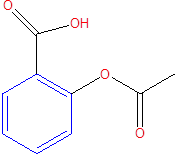
Figura 1. Molécula del ácido acetilsalicílico-Fuente: elaborada con el emulador ChemDraw: @VianniS
La espectroscopia infrarroja es una técnica analítica que estudia las vibraciones de las moléculas en la zona infrarroja del espectro electromagnético. Las técnicas analíticas de espectroscopia son utilizadas con la finalidad de elucidar estructuras químicas en los diferentes campos de la ciencia, también en la determinación de rutas metabólicas. El principio de esta técnica es que los enlaces con los que están unidos los átomos vibran a determinadas frecuencias, que son los niveles de energía de la molécula.
La espectrometría infrarroja por transformada de Fourier (FTIR) es un método para producir los espectros infrarrojos con mayor velocidad, esto básicamente se trata en dirigir la luz IR por un interferómetro luego de pasarla por la muestra para registrar el interferograma. Esto lo que hace es transformar los datos de tiempo a frecuencias para mostrarnos un espectro mucho más amigable para la lectura e interpretación de los resultados.
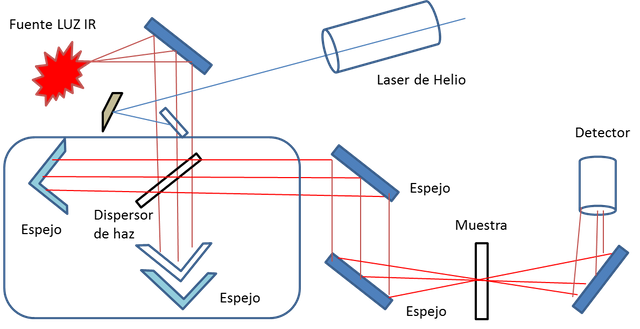
Figura 2. Espectrometro infrarrojo.-Fuente: @VianniS
En general, esta espectroscopia se puede utilizar para muestras en cualquiera de sus estados (solido, líquido y gaseoso). Para cuantificar concentraciones en muestras liquidas es necesario conocer el espesor del paso óptico y garantizar la transparencia de las celdas. La información que pueden proporcionar los espectros infrarrojos es la presencia o ausencia de grupos funcionales de muestras orgánicas e inorgánicas. Para permitir la identificación de estas. El objeto del presente post es determinar la cantidad de ácido acetilsalicílico como aspirina comercial presente por la espectrometría infrarroja con transformada de Fourier.
Parte experimental
Inicialmente se pesaron dos comprimidos de aspirina (aspicor 81 mg) en un vidrio de reloj, luego se trituraron en mortero por separado hasta obtener un polvillo muy fino. Posteriormente al verificar su homogeneidad se disolvió con 3 ml de etanol (Sigma-Aldrich 99,8%) para luego someterlo a un proceso de sonificación ( con un BRANSON 2510) durante 10 min, luego de esto se filtró por gravedad y se enrazó hasta 10 mL.
Conjuntamente se preparó una disolución para realizar la curva de adición estándar a 1% para luego preparar alícuotas que contenían volúmenes variados de solución estándar con 0,8 mL de la solución de muestra a determinar y se llevó a un balón de 5 mL con etanol.
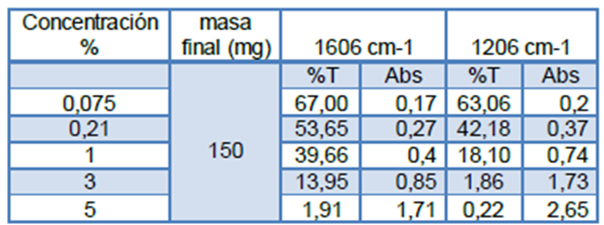
Luego se realizaron las mediciones IR en el equipo (Iraffinity-1 Fourier transform infrared spectrophotometer SHIMADZU). Para el caso de la preparación de las pastillas para el análisis infrarrojo en estado sólido, se realizó un procedimiento similar al anterior, pero claro está, la dilución se realizó con KBr de alta pureza donde se tomaron dos cantidades de la muestra previamente pulverizada y se diluyeron hasta 150 mg, finalmente se procedió a la medición de las pastillas en el mismo equipo utilizado para el análisis en estado líquido.
Resultados y discusión
A continuación se ilustran los espectros IR obtenidos para la construcción de las curvas de estándar externo realizadas y conjuntamente con los espectros utilizados para la construcción de las curvas de adición estándar.
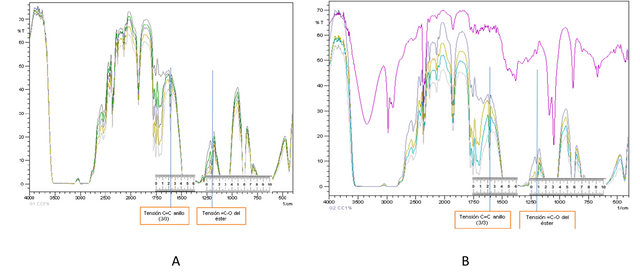
Figura 3. Espectros IR CCE conjuntamente con selección e identificación de picos utilizados para respectivas curvas de calibración- Fuente: @VianniS
Para el desarrollo de este trabajo se seleccionó en el caso de las figuras A y B como bandas principales las centrada alrededor de 1606 cm-1 (correspondiente a una tensiones C=C del anillo) y como bandas secundarias las centradas en 1206 cm-1 para la Figura A, y para la figura B alrededor de 1212 cm-1 (correspondiente a la tensión =C-O del grupo éster).
Figuras 4. Espectros IR AE conjuntamente con selección e identificación de picos utilizados para respectivas curvas de calibración- Fuente: @VianniS
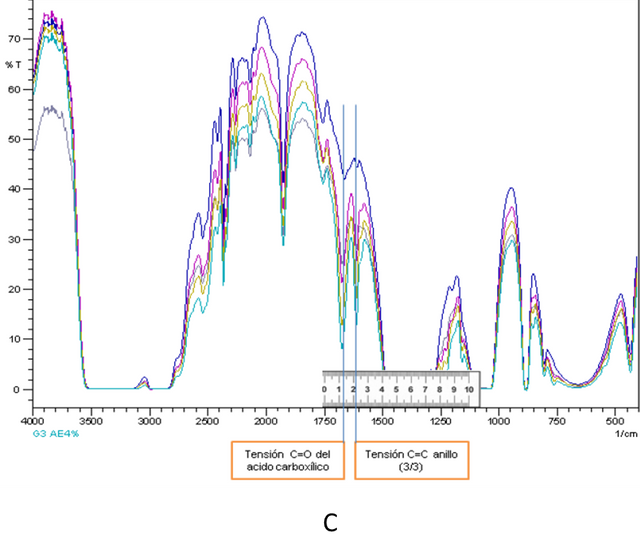
Para el caso de las adiciones estándar realizadas en la figura C se tomó como banda principal la centrada alrededor de 1668 cm-1 (tensión C=O del ácido carboxílico) y como secundaria 1606 cm-1 (tensión C=C del anillo), por otro lado para la figura D se tomó como banda principal la centrada alrededor de 1703 cm-1 (tensión C=O del ácido carboxílico) y secundaria 1612 (tensión C=C del anillo).
Cabe destacar que la selección de los picos mencionados anteriormente se realizó minuciosamente basándose en que son los picos que no son solapados por señales provenientes del solvente, y fueron seleccionados a su vez por presentar pocas interferencias al observarse picos bien pronunciados, no obstante es importante mencionar que los ligeros desplazamientos que se presentan en casi todas las bandas seleccionadas están relacionadas muy posiblemente con el comportamiento del solvente utilizado que en el caso de la práctica es el etanol.
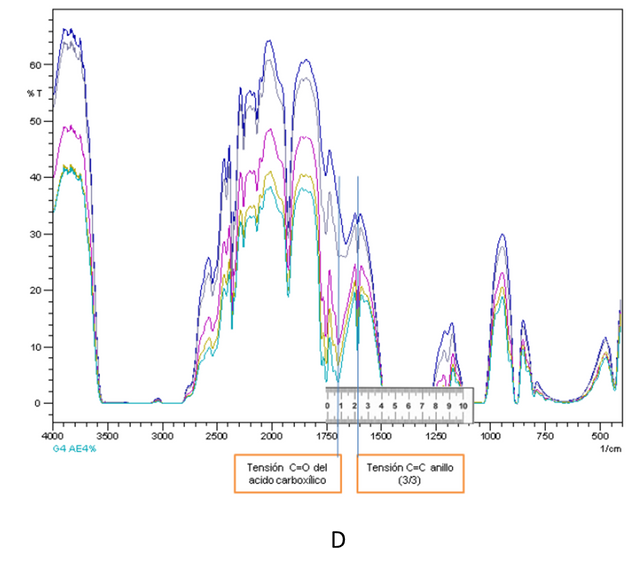
Figuras 5. Espectros IR AE conjuntamente con selección e identificación de picos utilizados para respectivas curvas de calibración-Fuente: @VianniS
Luego de lo mencionado anteriormente, se muestran a continuación las tablas de datos con sus respectivas curvas de calibración y curvas de adición estándar realizadas
A partir de estos datos se construyen las curvas de calibración que se muestran a continuación.
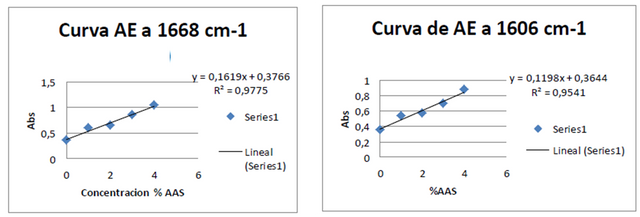
Figuras 6. Curvas de adición estándar a 1668 cm-1 y 1606 cm-1 Fuente: @VianniS
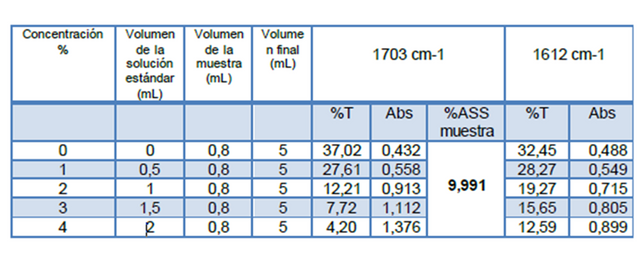
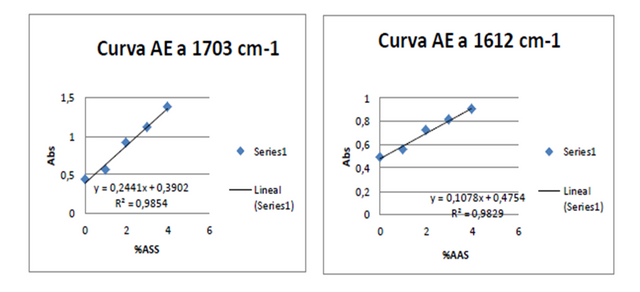
Figuras 7. Curvas de adición estándar a 1703 cm-1 y 1612 cm-1 Fuente: @VianniS
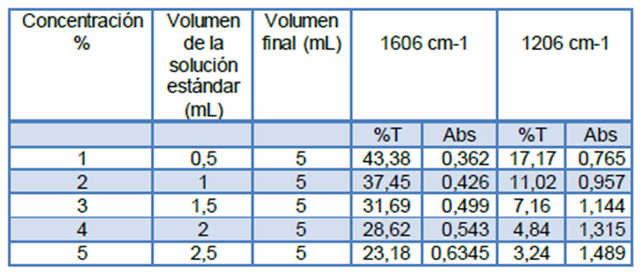
Figuras 8. Curvas de adición estándar a 1606 cm-1 y 1206 cm-1 Fuente: @VianniS

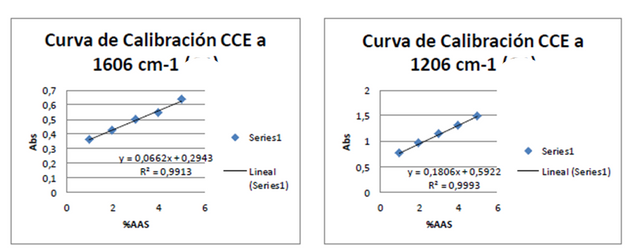
Figuras 9. Curvas de calibración externa a 1606 cm-1 y 1206 cm-1 Fuente: @VianniS
Posterior a la construcción de todas las curvas respectivas, y partiendo que los métodos utilizados tuvieron la misma precisión es posible comparar la sensibilidad, a través de comparación de las pendientes de las curvas correspondientes, partiendo entonces que a mayor pendiente mayor sensibilidad. Es por ello que para la determinación de la concentración de ácido acetilsalicílico con el método de adición estándar realizado se decido trabajar con la frecuencia 1668 cm-1 (tensión C=O; ácido carboxílico) y la frecuencia 1703 cm-1, calculando entonces la concentración de ácido acetilsalicílico para las muestras tratadas con el método de adición estándar cuyos valores se encuentran reflejados en las tablas 1 y 2. Cabe destacar que las muestras de ácido acetilsalicílico tratadas por cada método fueron independientes, es decir, en cada caso se trabajó con su propia muestra problema.
Basado en los criterios expuestos anteriormente para la selección de frecuencia y curva de calibración (mejor pico característico y curva con mejor sensibilidad), se procedió a escoger el pico centrado alrededor de 1206 cm-1 (Tensión =C-O del éster), obteniendo en cuestión los datos que se muestran en la tabla siguiente:
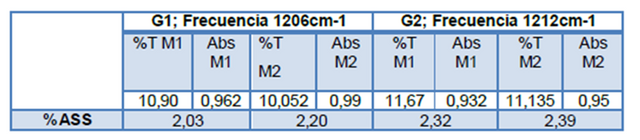
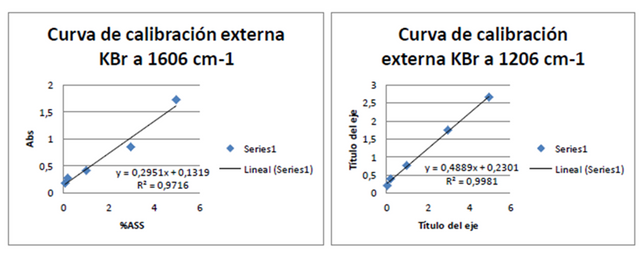
Para la determinación de la concentración de ácido acetilsalicílico por el método de la pastilla de KBr, en primer lugar se construyó la curva de calibración externa respectiva cuyo espectro infrarrojo se muestra a continuación:
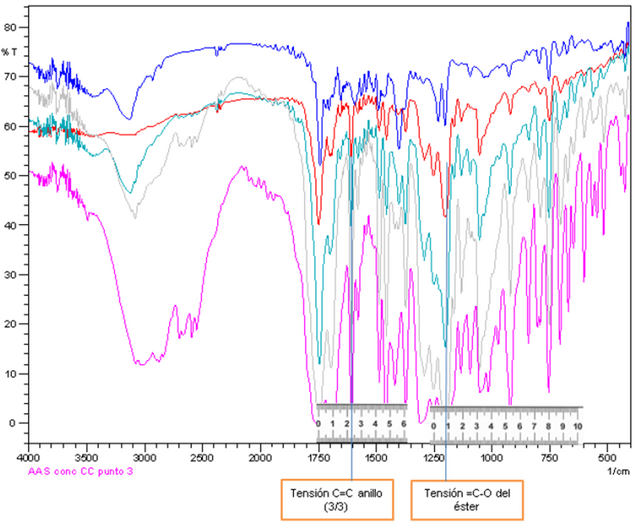
Figuras 10. Espectros IR para curva de calibración externa para método de la pastilla, conjuntamente con la selección de frecuencia más adecuada. Fuente: @VianniS
Se muestran a continuación las tablas de datos con sus respectivas curvas de calibración externas utilizadas para el método de la pastilla:
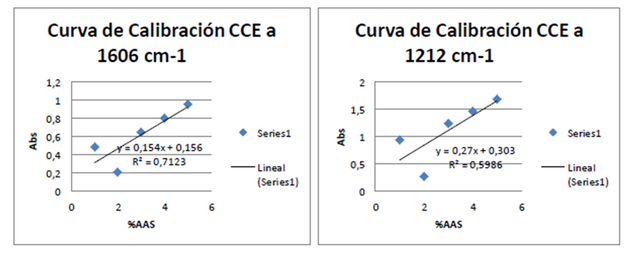
Figuras 11. Curvas de adición estándar a 1606 cm-1 y 1212 cm-1 Fuente: @VianniS
Es importante también ilustrar el espectro infrarrojo de la muestra a la cual se le determinara la concentración de ácido acetilsalicílico, y se muestra en la figura 12.
Figura 12. Espectro IR para el punto 0% de ASS.
Grafica referencial para la creación de este tipo de espectros. Fuente: @VianniS
Al comparar las dos curvas de calibración se visualiza que la realizada a 1606 cm-1 se presenta una mayor pendiente y por ende una mayor sensibilidad, por lo cual se procedió a la determinación de %ASS utilizando dicha Curva de calibración externa obteniendo así los datos a continuación:
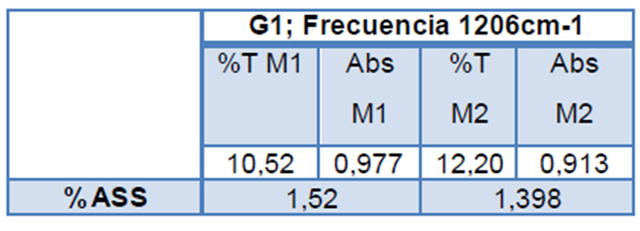
Los espectros que soportan la información reflejada en la tabla anterior se encuentran a continuación.
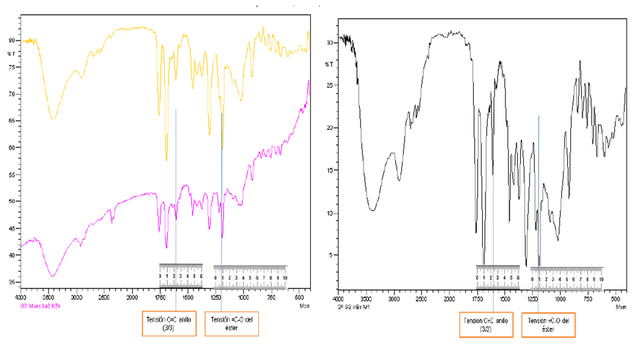
Figura 13. Curvas de muestras de KBr conjuntamente con selección de frecuencias para la cuantificación. Fuente: @VianniS
Es importante mencionar que en los análisis de infrarrojo se basan en las transiciones vibracionales y rotacionales, que en el caso de esta práctica se estarán tratando solo las transiciones vibracionales, esto debido a que la técnica IR es una técnica de baja energía la cual no es capaz de generar transiciones electrónicas, es decir, que no es capaz de excitar electrones de valencia. En el caso de la cuantificación de la muestra de aspirina comercial se realizó la mayoría de ellas con picos que se encuentran a mayor frecuencia, esto debido a que poseen poca interferencia y se encuentran bien definidos, solo en el caso de la determinación del %ASS con la curva de calibración externa para las pastillas se tomó un pico en la zona dactilar del espectro pero manteniendo su carácter de tensión, el cual se encuentra centrado alrededor de 1206 cm-1. Otro punto importante es mencionar que todo espectro emitido por el equipo lleva una respuesta luego de haberse procesado a través de un algoritmo matemático llamado Transformada de Fourier, el cual consiste en la superposición de señales para encontrar parámetros repetitivos como la señal y el ruido, siempre y cuando la señal detectada sea del tipo sinusoidal, en el caso de los equipos de IR que trabajan con este tipo de algoritmos matemáticos solo se lleva a cabo por la presencia de un interferómetro cuyo mecanismo se mencionó en la introducción del presente post, dicho dispositivo funciona como monocromador procesando la radiación electromagnética involucrada y generando en cuestión una serie de diversas longitudes de onda las cuales serán tratadas por ecuaciones diferenciales siendo posible la creación del interferograma y posteriormente el espectro respectivo, el cual si es emitido.
Conclusiones
• Se logró determinar las concentraciones de las muestras comerciales de aspirina, corroborando en cuestión la vialidad de la utilización de técnicas de infrarrojo para métodos de cuantificación.
• Se reforzaron conocimientos relacionados a la elucidación de estructuras a través de interpretación de espectros de infrarrojo.
• Se adquirió conocimiento relacionado a la manipulación y manejo de equipos de espectrometría de infrarrojo.
• Se realizaron las curvas de calibración externa y de adición estándar, pudiendo comparar y seleccionar la curva más sensible para así aplicarla y determinar la concentración del analito.
Espero que les haya nutrido de conocimiento científico. Y si quieren seguir leyendo contenido de calidad e interactuar con científicos, médicos e ingenieros de diferentes áreas les extiendo la invitación a nuestro canal de Discord de la comunidad científica #Stem-espanol
¡Felicitaciones!
Apoya al trail de entropía y así podrás ganar recompensas de curación de forma automática, entra aquí para más información sobre nuestro TRAIL.
Puedes consultar el reporte diario de curación visitando @entropia
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Gracias por su apoyo constante. Buen trabajo realizado por ustedes.
Buen aporte @viannis. Muy buen tratamiento de los datos para validar la técnica.
Gracias estimada @yusvelasquez. Siempre atenta a mis post
This post has been voted on by the steemstem curation team and voting trail.
There is more to SteemSTEM than just writing posts, check here for some more tips on being a community member. You can also join our discord here to get to know the rest of the community!
Your job is the best. Thanks to the support
Hi @viannis!
Your post was upvoted by utopian.io in cooperation with steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
Saludos @viannis. Muy buen post, ya habia utilizado la técnica solo para la identificación de compuestos, excelente el método para también realizar la cuantficación de los mismos
Excelente post, concreto y muy informativo! Saludos.