Identificación de gases por medio de un Espectrómetro de rejilla
Hola amigos en el presente artículo quiero mostrar un experimento que realice hace un par de años durante el curso de una materia en mi carrera de pre-grado, donde pudimos observar e identificar diferentes espectros de emisión de gases, en ello pudimos ver lineas espectrales a través de espectrómetro de rejilla, lamentablemente las fotos que tome durante la práctica no las pude encontrar en mi computadora, pero si encontré el informe detallado de dicha práctica, junto con la metodología y resultados experimentales. En principio quiero hablar de la parte teórica que en un 90% se encuentra en la web, ya que es un tema que se estudio hace muchos años atrás y como es un experimento sencillo, pero muy importante, la mayoría de las universidad a nivel mundial lo dictan en sus carreras, como fuente de aprendizaje para futuros físicos, luego explicare toda la metodología usada en el experimento y finalmente los resultados con sus respectivos análisis.
Resumen
La espectrometría es una técnica que se encarga del estudio de la materia cuando esta hace uso de su interacción con la radiación. En la presente investigación es de interés solo la espectrómetria de emisión, por medio de la cual se propone identificar tres diferentes gases desconocidos en primera instancia, a partir de la observación de lineas espectrales obtenidas en un espectrómetro, así como también determinar la constante de Rydberg estudiando el espectro obtenido de vapor de agua usando el análisis de Serie de Balmer.
Fundamentos teóricos
La espectrometría de emisión es una técnica que sirve para analizar longitudes de onda de los fotones emitidos por los átomos o moléculas durante su transición desde un estado excitado a un estado de inferior energía. Cada elemento emite un conjunto característico de longitudes de onda discretas en función de su estructura electrónica. Mediante la observación de estas longitudes de onda puede determinarse composición elemental de la muestra [1].
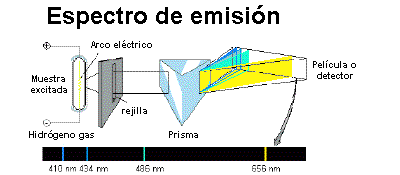
Esquema de la espectrometría de emisión
Esta se descubrió en el siglo XVII por Isaac Newton, quien descubrió que la luz blanca al pasar por un prisma de vidrio se descompone en luz con colores del arco iris. Desde entonces comenzaron los estudios experimentales para poder determinar las longitudes de onda de diferentes líquidos y así vez observar los espectros de luz visible de dichas sustancias [2].

Sir Isaac Newton
Luego en el siglo XIX el prisma fue usado para la descomposición de la luz con rendijas y lentes telescópicas con los que se consiguió una herramienta más potente para examinar la luz procedente de distintas fuentes.

Esquema de la luz difractada por medio del prisma
A través del espectroscopio desarrollado en el siglo XVII se descubrió que el espectro de luz solar estaba dividido por unas series de líneas oscuras; por otro lado la luz generada en el laboratorio mediante el calentamiento de gases, metales y sales mostraba una serie de líneas estrechas, coloreadas y brillantes sobre un fondo oscuro. Por lo tanto surgió la idea de utilizar estos espectros como huella digital de los elementos observados [3].

Módelo de espectroscopio antiguo

Espectroscopio antiguo
Me enamoré de esta foto por ello quise compartirla con ustedes :).
Ahora bien vamos a identificar la composición de un espectrómetro común, este consta de tres elementos fundamentales que constituyen en su funcionamientos las cuales son:
Colimador: se trata de una pequeña rendija usada para estrechar y alinear el haz de luz con el fin de direccionar correctamente hacia el elemento difractante.
Elemento difractante: es aquel que se encarga de doblar el haz y dividirlo formando un espectro. Esta función la cumple la rejilla de dirección o el prisma dentro del espectrómetro.
Ocular: por medio de este son observadas las líneas espectrales resultantes de la difracción del haz para medir la longitud de onda de cada una.
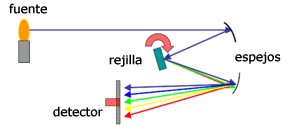
Componentes de un espectroscopio
Para este estudio se utilizó un espectrómetro con una rejilla de difracción como elemento difractante.
Durante la época del siglo XIX, surgió un interés notable sobre este tipo de fenómenos.
Uno de los científicos destacados fue Johann Balmer, el cual ideo un modelo matemático mediante el cual podían ser obtenidas las longitudes de onda características de las líneas espectrales del hidrógeno y elementos similares. Más tarde Johannes Rydberg mejoría este modelo haciéndolo en dependencia del número de onda en vez d su longitud, a esto fue agregado un valor constante el cual lleva su nombre como:
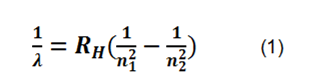
Donde λ es la longitud de onda, 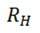 es la constante de rydberg,
es la constante de rydberg, 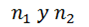 son los valores que representan los niveles orbitales del átomo, los cuales determinan la serie a utilizar, para el presente estudio fue de utilidad la llamada serie de balmer.
son los valores que representan los niveles orbitales del átomo, los cuales determinan la serie a utilizar, para el presente estudio fue de utilidad la llamada serie de balmer.
Para cálculo de las longitudes de onda correspondientes mediante la expresión:

Donde λ es la longitud de onda; d la distancia entre la líneas de la rejilla de difracción (d=1.66x10exp-3 para la rejilla de 600 líneas/mm, por ejemplo); θ es el ángulo de difracción; y m es el orden del espectro de difracción bajo observación.
Metodología experimental
Para pode realizar este experimento usamos el espectrómetro con rejilla difractante graduada, una lente con una resolución de 7500 líneas/pulg y una escala graduada a 10exp(-5)cm, 15000 lineas7pulg. Así como también una fuente de 5000V que genera 0,18 Amp para la determinación de gases desconocidos, 3 tubos contenedores de gases, los cuales vamos analizar detalladamente y observar sus líneas espectrales y una resistencia variable fijada a 750Ω.
A continuación identificaremos tres tipos de gases diferentres, para esto se conecta la resistencia variable entre la fuente y uno de los electrodos sobre los cuales es fijado el tubo de estudio, este último queda ubicado en frente del colimador del espectrómetro. Para calibrar este equipo se hace uso de un tubo contenedor de mercurio, se usa este gas por poseer líneas espectrales muy simples y fáciles de visualizar, con conocimiento de su longitudes de onda características emitidas se procede a ajustar la escala del espectrómetro, una vez calibrado procedemos a estudiar las muestras de los otros 3 gases donde observaremos sus respectivas longitudes de onda y la comparamos con los estudios teóricos y así poder identificar qué tipo de gas se obtiene.
Resultados y Análisis
Usamos el mercurio como elemento para poder calibrar el espectrómetro, el cual muestra en la tabla 1 las longitudes de onda correspondientes a este gas.
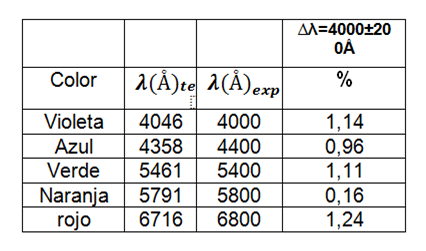
Tabla 1. Longitudes de onda del espectro de emisión del gas de mercurio usadas para calibrar el instrumento.
Los resultados obtenidos durante el experimento que consistía en identificar el gas en los tubos fueron los siguientes:
Para el primer gas se muestra la siguiente tabla:
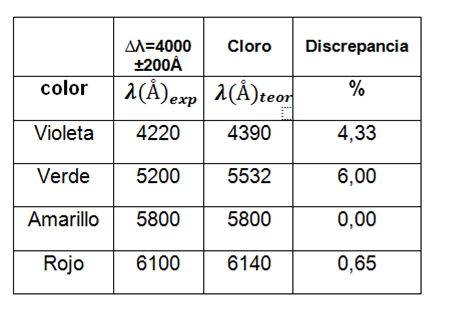
Tabla 2. Valores de las longitudes de onda observadas para el tubo 1.
Analizando el gas por medio de la aplicación AtomicSpectra observamos y comparamos el espectro de emisión y decimos que el gas contenido en el tubo es el cloro.
Para el segundo gas se muestra la siguiente tabla:
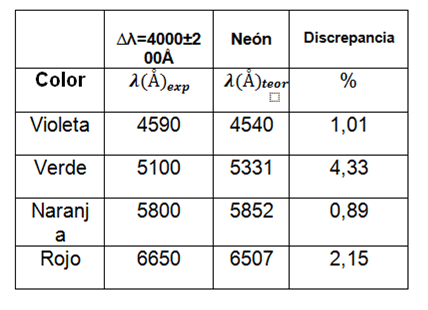
Tabla 3. Valores de las longitudes de onda observadas para el tubo 2.
Por medio del AtomicSpectra comparamos los resultados e identificamos el gas siendo este neón.
Para el tercer gas se muestra la siguiente tabla:
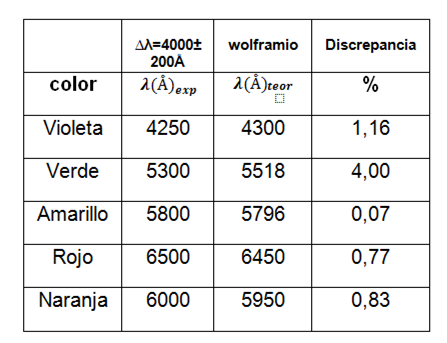
Tabla 4. Valores de longitudes de observadas para el tubo 3.
Usando el AtomicSpectra para comprar los resultados identificamos el gas como el wolframio.
Ahora en la segunda parte de este experimento calcularemos la constante Rydberg del tubo de mercurio, con los resultados obtenidos experimentalmente de sus espectros de colores, esta constante tiene un valor teórico de 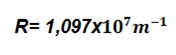 , el cual compararemos y obtendremos su discrepancia %.
, el cual compararemos y obtendremos su discrepancia %.
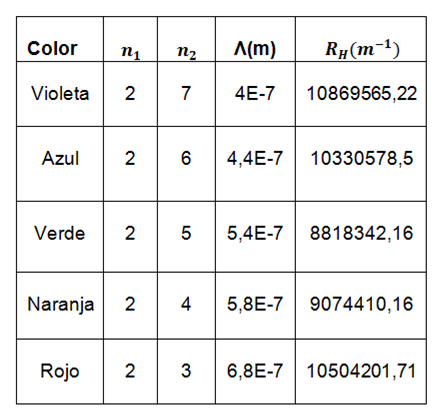
Tabla 5. Muestra los valores de longitud de onda tomados para el cálculo de la ecuación (1).
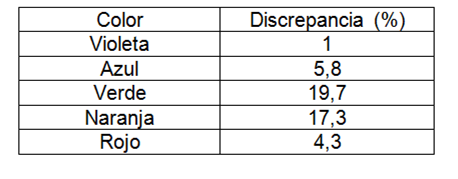
Tabla 6. Discrepancia de espectro de mercurio.
A partir de la tabla 5 se obtuvo el cálculo de error:
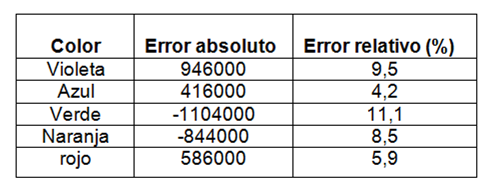
Tabla 7. Muestra el cálculo de errores de los espectros del mercurio obtenidos con la ecuación (1).
Conclusiones y Recomendaciones
En la primera parte de esta experiencia podemos concluir que el objetivo fue logrado satisfactoriamente ya que pudimos visualizar por medio de los tubos de los diferentes gases las longitudes de onda correspondientes a cada espectro de emisión, con un margen de error o discrepancia del 0,92 para el mercurio, 2,7 para el cloro, 2,1 para el neón y 1,37 para el wolframio.
En la segunda parte se logró también calcular la constante de Rydberg del el gas de mercurio con una discrepancia del 9,6%.
Debemos tomar en cuenta que estas experiencias se realizaron con un error de entrada del 5% por lo cual los errores fueron altos, además debemos considerar que también la marca o tipo de espectrómetro es muy importante para poder visualizar las líneas espectrales de manera más nítida y sus longitudes de onda sean precisas, la rejilla no tiene un poder de resolución adecuado para visualizar bien las líneas espectrales. Otro punto a tomar en consideración son los errores aleatorios influyen de manera grande en la realización de este experimento.
Referencias
Robert Eisberg y Robert Resnick. “FISICA CUANTICA”. 2011. Editorial Limusa Wiley. P 126-130.
Mark Kness, 2002. Aplicacion AtomicSpectra V1.0 Copyright 2002.
Si desea leer más artículos científicos de buena calidad, no pierda el tiempo, y visite la etiqueta #steemstem, es un gran proyecto que ha crecido enormemente en los últimos meses, con el fin de promover altos puestos a publicaciones científicas.
Para obtener más información al respecto, únase a nuestro canal en steemitchat, o también puede hacerlo en discord.

Que fascinante es el mundo de la Espectrometría! Excelente post Carlos!
Sin duda alguna lo es! :) gracias por pasarte saludos!!
Todo lo referente a la Espectrometría llama siempre mi atención.
Excelente que puedan realizar este tipo de experiencias que dejan un gran aprendizaje
Por supuesto es un experimento básico en la carrera de pregrado de licenciatura en física pura... gracias por leer
Que buen trabajo. Se ve que le dedicaste bastante tiempo!! Un saludo
Muchas gracias, me alegra que te guste lo que publico..
Que buen trabajo haces de verdad, jeje aunque me cuesta entender estos temas tu lo resumes muy bien, puedo decir que algo que me queda.
Es un tema sencillo solo dos ecuaciones lo demás todo es experimental, por supuesto que hay que leer mucho para entender, pero me alegra mucho que te guste!!
saludos..
Hola @carloserp-2000. Excelente post. Siempre he pensado que la espectroscopía es un mundo fascinantemente complejo. Especialmente importante para las ciencias exactas como la física y química
Por supuesto gracias a ello podemos observar las huellas digitales de cada material por decirlo vulgarmente :D
Muy buen artículo @carloserp-2000. Felicitaciones!.
Gracias @tsoldovieri
Excelente @carlosserp-2000, yo también tuve la oportunidad de ver ésta practica en el laboratorio de física moderna y ondas en mi universidad. Me animaste a publicar mi práctica de Espectroscopía :). Un día de estos voy a buscar mi guía de practicas y publico para comparar. saludos!
Excelente amigo espero leer tu practica :)